题目内容
2.下列关于有机物的说法正确的是( )| A. | 乙酸的分子式为CH3COOH,属于弱电解质 | |
| B. | 苯分子中没有碳碳双键,因此苯不能发生加成反应 | |
| C. | 交警用酸性重铬酸钾溶液检查司机是否饮酒过量时乙醇发生取代反应 | |
| D. | 乙烯能使酸性KMnO4溶液和溴水褪色,二者反应原理不相同 |
分析 A.乙酸的分子式为C2H4O2,在水中不能完全电离;
B.苯与氢气可发生加成反应生成环己烷;
C.重铬酸钾溶液与乙醇发生氧化反应;
D.乙烯与高锰酸钾发生氧化反应,与溴水发生加成反应.
解答 解:A.乙酸的分子式为C2H4O2,结构简式为CH3COOH,在水中不能完全电离,属于弱电解质,故A错误;
B.苯与氢气可发生加成反应生成环己烷,需要催化剂、加热,故B错误;
C.重铬酸钾溶液与乙醇发生氧化反应,而不是取代反应,故C错误;
D.乙烯与高锰酸钾发生氧化反应,与溴水发生加成反应,均褪色,但原理不同,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应等为解答的关键,侧重分析与应用能力的考查,注意有机物的组成、性质及应用,题目难度不大.

练习册系列答案
相关题目
12.下列关于能源的说法不正确的是( )
| A. | 氢气的热值高,无污染,是一种有待开发的“绿色能源” | |
| B. | 乙醇可以直接作为燃料,也可以和汽油混合作为发动机燃料 | |
| C. | 煤的气化和液化,即可以减少污染又可以提高燃烧的热效率 | |
| D. | 甲醇燃料电池不能得到推广应用,是由于能量转化率低 |
13.下列互为同素异形体的一组物质是( )
| A. | CO2和CO | B. | 35Cl和37Cl | ||
| C. | CH3COOH和HCOOCH3 | D. | 红磷和白磷 |
10.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 分子数为NA的CO、C2H4混合气体体积为22.4L,质量为28g | |
| B. | 标准状况下,2.24 L Cl2溶于水得新制氯水,该过程中转移的电子数目为0.1NA | |
| C. | 物质的量均为1 mol的过氧化钠和氧化钠中阴离子个数均为NA | |
| D. | 0.1 mol•L-1的NaHSO4溶液中,阳离子的数目之和为0.2NA |
17.某烃的衍生物分子式可写成(CH2)m(CO2)n(H2O)m,当它完全燃烧时,生成的CO2与消耗的O2在同温同压下体积比为1:1,则m、n的比值为( )
| A. | 1:1 | B. | 2:3 | C. | 1:2 | D. | 2:1 |
7.下列各组离子在指定溶液中,一定能大量共存的是( )
| A. | 在由水电离出的c(OH-)=1×10-13mol/L的溶液中:Na+、Al3+、Cl-、NO3- | |
| B. | 在加入铝粉能产生H2的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| C. | 在澄清透明的溶液中:Cu2+、K+、SO42-、Cl- | |
| D. | 在能使甲基橙变黄色的溶液中:Na+、CO32-、NO3-、K+ |
14.下列反应中,属于加成反应的是( )
| A. | CH2═CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl | B. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | ||
| C. | C2H4+3O2$\stackrel{点燃}{→}$2CO2+2H2O | D. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ |
2.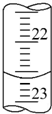 某学生用0.100 0mol•L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
某学生用0.100 0mol•L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液.需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要500mL容量瓶.
(2)滴定:
Ⅰ.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上.
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“0”刻度线以下,并记录读数.
Ⅲ.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液.
Ⅳ.用标准液滴定至终点,记录滴定管液面读数.
①上述滴定步骤中有错误的是(填编号)Ⅰ,该错误操作会导致测定结果偏大
(填“偏大”“偏小”或“无影响”).
②步骤Ⅳ中滴定时眼睛应观察锥形瓶中溶液颜色的变化,判断滴定终点的现象是当滴加最后一滴标准液时,待测液由红色刚好变为无色,且半分钟内不变色.
③若步骤Ⅱ中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果偏小(填“偏大”“偏小”或“无影响”).
(3)按正确操作测得有关数据记录如下:
①a的读数如图所示,则a=22.60;
②烧碱样品的纯度为80.8%.
 某学生用0.100 0mol•L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:
某学生用0.100 0mol•L-1盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应).实验步骤如下:(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液.需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要500mL容量瓶.
(2)滴定:
Ⅰ.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上.
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“0”刻度线以下,并记录读数.
Ⅲ.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液.
Ⅳ.用标准液滴定至终点,记录滴定管液面读数.
①上述滴定步骤中有错误的是(填编号)Ⅰ,该错误操作会导致测定结果偏大
(填“偏大”“偏小”或“无影响”).
②步骤Ⅳ中滴定时眼睛应观察锥形瓶中溶液颜色的变化,判断滴定终点的现象是当滴加最后一滴标准液时,待测液由红色刚好变为无色,且半分钟内不变色.
③若步骤Ⅱ中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果偏小(填“偏大”“偏小”或“无影响”).
(3)按正确操作测得有关数据记录如下:
| 滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.20 | 20.38 |
| 第二次 | 20.00 | 4.00 | 24.20 |
| 第三次 | 20.00 | 2.38 | a |
②烧碱样品的纯度为80.8%.