题目内容
100g浓度为c1的浓氨水(溶质质量分数为ω1)与Vml的谁混合,得浓度为c2的稀氨水(溶质质量分数为ω2),下列说法正确的是( )
| A、若ω1=2ω2,则c1<2c2,V=100ml |
| B、若ω1=2ω2,则c1>2c2,V=100ml |
| C、若c1=2c2,则ω1<2ω2,V>100ml |
| D、若c1=2c2,则,ω1=2ω2,V=100ml |
考点:溶液中溶质的质量分数及相关计算
专题:
分析:利用c=
计算氨水的浓度,结合氨水溶液的浓度越大密度越小进行判断;根据稀释前后溶质的质量不变计算混合后溶液的质量,计算水的质量,据此计算水的体积,根据计算结果判断A、B;
利用c=
公式变形计算氨水的质量分数,结合氨水溶液的浓度越大密度越小进行判断;根据稀释前后溶质的物质的量不变,混合后溶液的体积为原氨水的2倍,氨水溶液的浓度越大密度越小,所以混合后溶液的质量大于200g,故水的质量大于100g,据此判断水的体积,然后根据计算结果判断C、D.
| 1000ρω |
| M |
利用c=
| 1000ρω |
| M |
解答:
解:设物质的量是浓度为c1 mol?L-1的氨水的密度为ρ1,物质的量是浓度为c2mol?L-1硫酸溶液的密度为ρ2,则:c1=
mol/L,c2=
mol/L,所以
=
=
,氨水的浓度越大密度越小,则ρ1<ρ2,故c1<2c2;
稀释前后溶质的质量不变,若ω1=2ω2,则稀释后溶液的质量为200g,所以水的质量为100g,水的密度为1g/mL,所以水的体积V=100mL,故A正确、B错误;
设物质的量是浓度为c1 mol?L-1的氨水的密度为ρ1,物质的量是浓度为c2mol?L-1氨水溶液的密度为ρ2,则
由c=
可知,ω1=
,ω2=
,
所以
=
,由于c1=2c2,所以
=
,
因浓氨水的密度小于水,溶液的浓度越大,密度越小,则ρ1<ρ2,所以ω1>2ω2;
根据稀释前后溶质的物质的量不变,混合后溶液的体积为原氨水的2倍,氨水溶液的浓度越大密度越小,所以稀释后溶液的质量大于200g,故水的质量大于100g,水的密度为1g/mL,所以水的体积V>100mL,所以C、D错误;
故选A.
| 1000ρ1ω1 |
| 17 |
| 1000ρ2ω2 |
| 17 |
| c1 |
| c2 |
| ρ1ω1 |
| ρ2ω2 |
| 2ρ1 |
| ρ2 |
稀释前后溶质的质量不变,若ω1=2ω2,则稀释后溶液的质量为200g,所以水的质量为100g,水的密度为1g/mL,所以水的体积V=100mL,故A正确、B错误;
设物质的量是浓度为c1 mol?L-1的氨水的密度为ρ1,物质的量是浓度为c2mol?L-1氨水溶液的密度为ρ2,则
由c=
| 1000ρω |
| M |
| 17c1 |
| 1000ρ1 |
| 17c2 |
| 1000ρ2 |
所以
| ω1 |
| ω2 |
| c1ρ2 |
| c2ρ1 |
| ω1 |
| ω2 |
| 2ρ2 |
| ρ1 |
因浓氨水的密度小于水,溶液的浓度越大,密度越小,则ρ1<ρ2,所以ω1>2ω2;
根据稀释前后溶质的物质的量不变,混合后溶液的体积为原氨水的2倍,氨水溶液的浓度越大密度越小,所以稀释后溶液的质量大于200g,故水的质量大于100g,水的密度为1g/mL,所以水的体积V>100mL,所以C、D错误;
故选A.
点评:本题考查物质的量浓度、质量分数的有关计算,题目难度较大,明确氨水密度比水小,且氨水浓度越大密度越小为解答本题关键,注意熟练掌握物质的量浓度与溶质质量分数的转化关系.

练习册系列答案
相关题目
NA代表阿伏加德罗常数,下列判断正确的是( )
| A、2.4g金属Mg变为Mg2+时失去的电子数为0.1 NA |
| B、等物质的量的N2和CO所含原子数相同,质量相同 |
| C、在标况下,22.4 L H2O所含氢原子为2NA |
| D、1L 0.1 mol?L-1的乙酸溶液中H+数为0.1 NA |
下列说法正确的是( )
| A、H2O2分子间存在氢键 |
B、在氨水中,大部分NH3与H2O以氢键结合成NH3?H2O分子,可表示为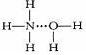 |
| C、石英熔化只与范德华力有关 |
| D、PH3的沸点比NH3高 |
已知反应:①A2+2B-=2A-+B2②B2+2C-=2B-+C2③C2+2D-=2C-+D2,则A-、B-、C-、D-还原性的正确顺序是( )
| A、A->B->C->D- |
| B、D->C->B->A- |
| C、A->D->B->C- |
| D、D->B->A->C- |
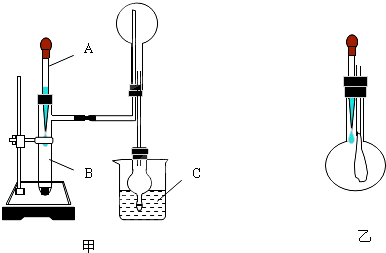
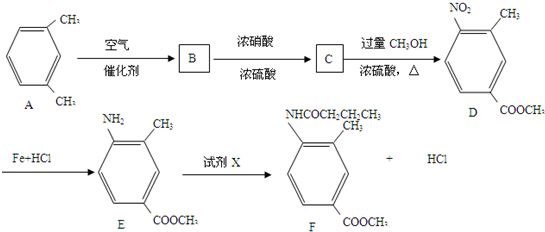
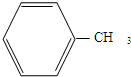 制备化合物
制备化合物