题目内容
4.下列叙述正确的是( )| A. | 有单质参加和单质生成的化学反应一定是氧化还原反应 | |
| B. | 盐酸是强酸,所以盐酸是强电解质 | |
| C. | 向FeCl3饱和溶液滴加NaOH溶液可制备Fe(OH)3胶体 | |
| D. | 化合反应不一定是氧化还原反应 |
分析 A.同素异形体的转化中没有化合价的变化;
B.电解质必须是化合物,盐酸是氯化氢的水溶液是混合物;
C.向沸腾的NaOH稀溶液中滴加FeCl3,生成Fe(OH)3沉淀;
D.化合反应中不一定存在元素的化合价变化.
解答 解:A.同素异形体的转化中没有化合价的变化,如O2═O3,则有单质参加和单质生成的化学反应不一定是氧化还原反应,故A错误;
B.氯化氢在水溶液中,能完全电离,HCl=H++Cl-,是强酸是自身电离,是电解质,盐酸是氯化氢的水溶液是混合物,不是电解质,故B错误;
C.实验室制备氢氧化铁胶体,是在沸腾的蒸馏水中加入饱和氯化铁溶液加热,当溶液变为红褐色时应立即停止加热,即可以得到氢氧化铁胶体,反应为FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,向沸腾的NaOH稀溶液中滴加FeCl3,生成Fe(OH)3沉淀,故C错误;
D.化合反应中不一定存在元素的化合价变化,如CaO与水反应为非氧化还原反应,而单质参加的化合反应如C燃烧为氧化还原反应,所以化合反应不一定是氧化还原反应,故D正确;
故选D.
点评 本题考查氧化还原反应、基本反应类型、电解质及胶体的制备,明确同素异形体的互变及反应中化合价的变化是解答本题的关键,难度不大.

练习册系列答案
相关题目
14.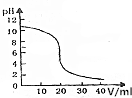 常温下,向20mL0.1000mol•L-1的氨水溶液中逐滴加入0.1000mol•L-的盐酸,pH随盐酸体积的变化如图所示.下列说法不正确的是( )
常温下,向20mL0.1000mol•L-1的氨水溶液中逐滴加入0.1000mol•L-的盐酸,pH随盐酸体积的变化如图所示.下列说法不正确的是( )
 常温下,向20mL0.1000mol•L-1的氨水溶液中逐滴加入0.1000mol•L-的盐酸,pH随盐酸体积的变化如图所示.下列说法不正确的是( )
常温下,向20mL0.1000mol•L-1的氨水溶液中逐滴加入0.1000mol•L-的盐酸,pH随盐酸体积的变化如图所示.下列说法不正确的是( )| A. | V=10.00mL时,c(NH4+)+c(NH3•H2O)=2c(Cl-) | |
| B. | V=20.00mL时,c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | pH=7时,消耗盐酸的体积大于20.00mL | |
| D. | pH=8时,c(NH4+)+c(H+)=c(Cl-)+c(OH-) |
15.人类只有一个地球,保护环境、保护地球已成为人类共同的呼声.下列说法不正确的是( )
| A. | 日本的水俣病是由重金属镉污染引起的 | |
| B. | 垃圾处理要遵循无害化、减量化和资源化的原则 | |
| C. | 水体的富营养化是由于水体中植物营养物质过多蓄积而引起的污染 | |
| D. | 污水处理中混凝法、中和法、沉淀法、氧化还原法等都是化学方法 |
12.已知:某密闭容器中,12gA加热完全分解产生B和C,其中B的质量为2g,同时C又能部分分解产生0.1gD和7.9gE,则最终该密闭容器中B和C的质量比为( )
| A. | 1:1 | B. | 1:2 | C. | 1:4 | D. | 1:5 |
19.设NA为阿伏加德罗常数的值,下列对1mol H2O的叙述错误的是( )
| A. | 质量为18g | B. | 含有NA个氧原子 | ||
| C. | 标准状况下体积约为22.4L | D. | 含有NA个水分子 |
9.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 无色溶液:Ca2+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| C. | 水电离出的c(H+)=10-13mol•L-1的溶液中:K+、Na+、SO42-、AlO2- | |
| D. | 有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
16.设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 1 mol 羟基(-OH)所含的电子总数为9NA | |
| B. | 有14g乙烯与丙烯混合气体,其含原子总数为3NA个 | |
| C. | 室温下,8g甲烷中含有共价键数为2 NA | |
| D. | 在78g苯中含3NA个碳碳双键 |
13.交警用于检测司机是否酒后开车的检测仪中含有的一种成份是重铬酸钾(K2Cr2O7),其中铬元素的化合价是( )
| A. | +3 | B. | +4 | C. | +5 | D. | +6 |