题目内容
8.某校化学小组学生利用图所列装置进行“铁与水反应”的相关实验,并利用产物进一步制取FeCl3•6H2O晶体.(图1中夹持及尾气处理装置均已略去)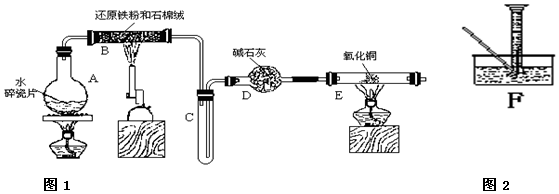
(1)装置B中发生反应的化学方程式是3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(2)装置E中的现象是红色的粉末变成黑色,管壁产生水珠.
(3)有同学为了研究一定时间内铁粉的转化率,他在上述装置后边连接了图2所示装置,为了计算铁粉的转化率,下列①③④数据是必需测量的(填序号).
①反应前铁粉的质量 ②D反应后的质量
③E反应前后的质量 ④F中收集的气体体积(标况)
(4)为了证明反应后的固体混合物中含有+3价的Fe,反应停止后取出B中混合物于试管中,加入足量的盐酸,溶解,过滤.取滤液少许滴加KSCN溶液,观察溶液的颜色.若观察到溶液变红,得出的结论是含有Fe3+(填写序号,下同);若观察到溶液不变红,得出的结论是不含有Fe3+.
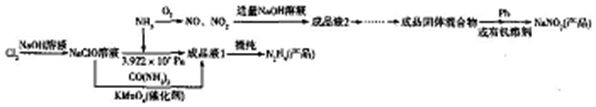
(5)该小组学生利用上述滤液制取FeCl3•6H2O晶体,设计流程如下:
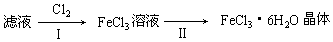
步骤I中通入Cl2的作用是将滤液中含有的Fe2+氧化成Fe3+.
步骤Ⅱ的主要操作有加热浓缩、冷却结晶、过滤、洗涤、干燥.
分析 由图可知,A提供水蒸气,B中发生3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,生成氢气具有可燃性,点燃时需要验纯,D中碱石灰干燥氢气,E中氢气还原CuO,结合铁离子遇KSCN溶液为血红色来解答.
(1)铁与水蒸气高温下反应生成四氧化三铁和氢气,据此写出反应的化学方程式;
(2)装置E中红色的氧化铁被氢气还原成黑色的铁,同时有水珠生成;
(3)转化率=$\frac{物质转化量}{物质起始量}×100%$,计算铁粉的转化率,需要反应前铁粉的质量和反应的铁粉,反应的铁粉可以通过生成的氢气计算;
(4)根据铁离子遇KSCN溶液为血红色;
(5)①根据流程结合氯气的强氧化性分析氯气的作用;
②由FeCl3稀溶液中得到FeCl3•6H2O晶体需加热浓缩、冷却晶体,过滤.
解答 解:(1)装置B中铁粉与水蒸气在高温下发生反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(2)装置B铁与水蒸气反应生成的氢气,经碱石灰干燥后加入装置E,氧化铁与氢气加热发生反应生成了铁和水,所以反应的现象为:红色的粉末变成黑色,管壁产生水珠;
故答案为:红色的粉末变成黑色,管壁产生水珠;
(3)转化率=$\frac{物质转化量}{物质起始量}×100%$,计算铁粉的转化率,需要反应前铁粉的质量和反应的铁粉,反应的铁粉可以通过生成的氢气计算,生成的氢气一部分与氧化铜反应,可以通过E反应前后的质量计算,另一部分收集在量筒中,故需要测量F中收集的气体体积(标况);
故答案为:①③④;
(4)为了证明反应后的固体混合物中含有+3价的Fe,反应停止后取出B中混合物于试管中,加入足量的盐酸,溶解,过滤.取滤液少许滴加KSCN溶液,观察溶液的颜色.若观察到溶液变红,说明混合物中含有Fe3+,若观察到溶液不变红,说明不含有Fe3+;
故答案为:含有Fe3+;不含有Fe3+;
(5)①因为氯气具有强氧化性,所以能将二价铁离子氧化为三价铁离子,2Fe2++Cl2═2Fe3++2Cl-,
故答案为:将滤液中含有的Fe2+氧化成Fe3+;
②由FeCl3稀溶液中得到FeCl3•6H2O晶体需加热浓缩、冷却结晶、过滤,
故答案为:加热浓缩;冷却结晶;过滤.
点评 本题考查了铁及其化合物的性质实验,题目难度中等,注意掌握铁与水蒸气反应原理,试题侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.

| A. | SO2使品红溶液褪色 | B. | 氯水使紫色石蕊试液褪色 | ||
| C. | SO2使高锰酸钾溶液褪色 | D. | 活性炭使比墨水褪色 |
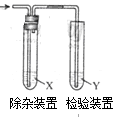 用图所示装置检验乙烯时不需要除杂的是( )
用图所示装置检验乙烯时不需要除杂的是( )| 乙烯 的制备 | 试剂X | 剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
| C | CH3CH2OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | CH3CH2OH与浓硫酸加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 稀盐酸、BaCl2溶液 | B. | 稀硝酸、BaCl2溶液 | ||
| C. | Ba(NO3)2溶液、稀盐酸 | D. | BaCl2溶液、稀盐酸 |
| 古文记载 | 对应的化学知识 | |
| A | 谚语:“雷雨发庄稼” | 放电条件下,氮气茎干一系列变化可以转化为氮肥 |
| B | 《望庐山瀑布》:“日照香炉生紫烟” | 碘的升华 |
| C | 《石灰吟》:“粉身碎骨浑不怕,要留清白在人间” | 碳酸钙高温下分解 |
| D | 《梦溪笔谈》中对宝剑的记载:“以剂钢为刃,柔铁为茎干,不尔则多断折” | 剂钢指的是铁的合金,其硬度比纯铁大 |
| A. | A | B. | B | C. | C | D. | D |
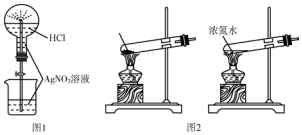
| A. | 用图1所示的装置做喷泉实验时观察到产生白色喷泉 | |
| B. | 如图2所示的两套装置均可制备NH3(不考虑净化和收集) | |
| C. | 称取2.5gCuSO4•5H2O,放入100mL容量瓶中,配制0.10mol•L-1CuSO4溶液 | |
| D. | 除去NaHSO3溶液中的Na2SO3,可加入Ba(OH)2溶液后过滤 |
 ,空间构型三角锥形
,空间构型三角锥形