题目内容
17.如图所示,有关实验或操作的叙述正确的是( )
| A. | 用图1所示的装置做喷泉实验时观察到产生白色喷泉 | |
| B. | 如图2所示的两套装置均可制备NH3(不考虑净化和收集) | |
| C. | 称取2.5gCuSO4•5H2O,放入100mL容量瓶中,配制0.10mol•L-1CuSO4溶液 | |
| D. | 除去NaHSO3溶液中的Na2SO3,可加入Ba(OH)2溶液后过滤 |
分析 A.结合氯化氢极易溶于水、且氯化氢与硝酸银溶液反应分析;
B.氢氧化钙和氯化铵反应时,试管口应向下倾斜;
C.容量瓶只能用来配置溶液,不能用来溶解溶质;
D.NaHSO3与Na2SO3都可与Ca(OH)2反应生成沉淀.
解答 解:A.图1中氯化氢易溶于水,且与硝酸银反应生成沉淀,可产生喷泉现象,故A正确;
B.实验室用氢氧化钙和氯化铵在加热制备氨气时,试管口应向下倾斜,故B错误;
C.配制一定物质的量浓度的溶液时,固体或液体不能直接在容量瓶中进行稀释,故C错误;
D.NaHSO3与Na2SO3都可与Ca(OH)2反应生成沉淀,不符合除杂的原则,故D错误;
故选A.
点评 本题综合考查化学实验方案的评价,题目侧重于喷泉实验、氨气的制备、溶液的配制以及除杂等问题,题目难度不大,注意把握相关物质的性质以及化学基本实验操作方法.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
12.碘化钠在医药中用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,也用作食品添加剂、感光剂等,工业上用水合肼(N2H4•H2O)还原法制取碘化钠固体,其制备流程如图所示:
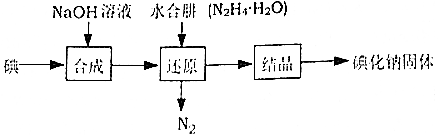
已知:N2H4•H2O在100℃以上分解
(1)在合成NaI的过程中,可能混有的物质是NaIO3,生产过程中要适当补充NaOH,目的是促使反应向生成物方向移动;
(2)在还原过程中,为了防止水合肼(N2H4•H2O)高温分解,反应温度控制在60~70℃,温度也不能过低,其原因是温度过低,降低化学反应速率,工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是N2H4•H2O的氧化产物为N2和H2O,不引入杂质;
(3)请设计一个简单的实验来检验还原液中是否含有IO3-:取适量还原液,加入淀粉溶液,加稀硫酸酸化,若溶液变蓝色,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含IO3-[可供选择的试剂:稀硫酸、淀粉溶液、FeCl3溶液]
(4)测定产品中NaI含量的实验步骤如下:
a.称取4.000g样品并溶解,在250mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用0.1000mol•L-1的Na2SO4溶液滴定至终点(发生反应方程式为2Na2S2O3+I2═Na2S4O6+2NaI),重复测定3次,所得的相关数据如表所示:
①在滴定过程中,Na2S2O3溶液应放碱式滴定管(填仪器)中,加入的A物质为淀粉(填名称);
②滴定终点观察到的现象为溶液蓝色褪去,且半分钟内不恢复;
③该样品中NaI的含量为90%;
④若用上述方法测得NaI的含量偏低(忽略测定过程中的误差),则可能的原因是部分NaI被空气中O2氧化;
(5)碘化钠固体的保存方法是用棕色瓶遮光、密封保存.

已知:N2H4•H2O在100℃以上分解
(1)在合成NaI的过程中,可能混有的物质是NaIO3,生产过程中要适当补充NaOH,目的是促使反应向生成物方向移动;
(2)在还原过程中,为了防止水合肼(N2H4•H2O)高温分解,反应温度控制在60~70℃,温度也不能过低,其原因是温度过低,降低化学反应速率,工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是N2H4•H2O的氧化产物为N2和H2O,不引入杂质;
(3)请设计一个简单的实验来检验还原液中是否含有IO3-:取适量还原液,加入淀粉溶液,加稀硫酸酸化,若溶液变蓝色,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含IO3-[可供选择的试剂:稀硫酸、淀粉溶液、FeCl3溶液]
(4)测定产品中NaI含量的实验步骤如下:
a.称取4.000g样品并溶解,在250mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用0.1000mol•L-1的Na2SO4溶液滴定至终点(发生反应方程式为2Na2S2O3+I2═Na2S4O6+2NaI),重复测定3次,所得的相关数据如表所示:
| 规定序号 | 待测体积/mL | 盛装标准滴定管的起点读数/mL | 盛装标准滴定管的终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
②滴定终点观察到的现象为溶液蓝色褪去,且半分钟内不恢复;
③该样品中NaI的含量为90%;
④若用上述方法测得NaI的含量偏低(忽略测定过程中的误差),则可能的原因是部分NaI被空气中O2氧化;
(5)碘化钠固体的保存方法是用棕色瓶遮光、密封保存.
5.下列有关实验操作和结论均正确的是( )
| 选项 | 操作 | 结论 |
| A | 配制Fe(NO3)2溶液时加入适量的硝酸 | 抑制Fe2+水解 |
| B | 浓硫酸和蔗糖反应产生的气体通过足量的KMnO4溶液,气体全部被吸收且溶液紫红色褪去 | “黑面包实验”产生的气体具有还原性 |
| C | 往溶液中滴加NaOH溶液,将湿润红色石蕊试纸置于试管口试纸不变蓝 | 原溶液中无NH4+ |
| D | 幼儿使用含NaF的牙膏,可以使牙齿上的Ca5(PO4)3OH转化为Ca5(PO4)3F,防止蛀牙 | Ksp[Ca5(PO4)3F]<Ksp[Ca5(PO4)3OH] |
| A. | A | B. | B | C. | C | D. | D |
2.一张浸润了溴水的滤纸,挂在盛有SO2的集气瓶中,它由黄色变为无色的原因是( )
| A. | 溴被SO2还原为无色的离子 | B. | SO2与Br2化合为一种无色的化合物 | ||
| C. | 反应放热,使溴挥发 | D. | SO2漂白了滤纸 |
9.下列溶液中通入足量SO2后,最终一定会出现沉淀的是( )
| A. | Na2S | B. | BaCl2 | C. | Ba(NO3)2 | D. | Ca(OH)2 |
6.氯气和氨水相比较,溶液中的微粒(离子、分子)种数( )
| A. | 氯气=氨水 | B. | 氯水>氨水 | C. | 氯水<氨水 | D. | 无法判断 |
1.下列各组离子在溶液中大量共存,且加入(NH4)2Fe(SO4)2•6H2O晶体后仍能大量存在的是( )
| A. | Na+、H+、Cl-、NO3- | B. | Na+、Mg2+、Cl-、SO42- | ||
| C. | K+、Ba2+、OH-、I- | D. | Cu2+、H+、Br-、ClO- |


 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$
 .
. (
(  与苯环性质相似)与
与苯环性质相似)与  合成
合成  的路线:
的路线: .
.