题目内容
 苯乙烯是重要的基础有机原料.工业中用乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式为:
苯乙烯是重要的基础有机原料.工业中用乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式为:C6H5-CH2CH3(g)?C6H5-CH=CH2(g)+H2(g)△H1
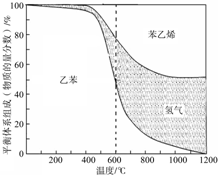
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:
由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
①氢气的物质的量分数为
②乙苯的平衡转化率为
③计算此温度下该反应的平衡常数(请写出计算过程).
(2)分析上述平衡体系组成与温度的关系图可知:△H1
(3)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率
(4)已知:
3C2H2(g)?C6H6(g)△H2
C6H6(g)+C2H4(g)?C6H5-CH2CH3(g)△H3则反应3C2H2(g)+C2H4(g)?C6H5-CH=CH2(g)+H2(g)的△H=
考点:化学平衡的计算,热化学方程式,化学平衡常数的含义
专题:化学反应中的能量变化,化学平衡专题
分析:(1)用三行式求出平衡时各组分的物质的量,然后应用
×100%解相关问题;仍然根据三行式求出平衡时各组的浓度,最后代入平衡常数表达式;
(2)由图可知温度升高,氢气平衡的物质量分数在增加,所以平衡正向移动,正反应为吸热反应;
(3)根据平衡移动原理,若反应体系中加入稀释剂,向计量数增加的方向移动;
(4)用盖斯定律解题.
| 该物质的物质的量 |
| 平衡混合体系的总量 |
(2)由图可知温度升高,氢气平衡的物质量分数在增加,所以平衡正向移动,正反应为吸热反应;
(3)根据平衡移动原理,若反应体系中加入稀释剂,向计量数增加的方向移动;
(4)用盖斯定律解题.
解答:
解:(1)①C6H5-CH2CH3(g)?C6H5-CH=CH2(g)+H2(g)
起始量 a mol 0 0
变化量 x mol x mol x mol
平衡量 (a-x)mol x mol x mol
由题可知:
×100%=25%,则x=
a,
即:a-x=2x,因为平衡体系中苯乙烯的物质的量分数为25%,则氢气的物质的量分数为25%,乙苯的物质的量分数为50%,
故答案为:25%;50%;
②乙苯的平衡转化率为
×100%=33%,故答案为:33%;
③C6 H5-CH2 CH3 (g)?C6 H5-CH=CH2 (g)+H2(g)
起始浓度/( mol?L-1):
0 0
变化浓度/( mol?L-1):
平衡浓度/( mol?L-1):
K=
=
,
故答案为:
;
(2)由图可知温度升高氢气平衡的物质量分数在增加,平衡正向移动,正反应为吸热反应,故答案为:>;
(3)在相同温度下,若反应体系中加入稀释剂,根据平衡移动原理,向计量数增加的方向移动,即正向移动,转化率增加,故答案为:>;
(4)由盖斯定律可知,目标反应可由①式+②式+③式得,所以反应热为△H1+△H2+△H3,故答案为△H1+△H2+△H3.
起始量 a mol 0 0
变化量 x mol x mol x mol
平衡量 (a-x)mol x mol x mol
由题可知:
| x |
| a-x+2x |
| 1 |
| 3 |
即:a-x=2x,因为平衡体系中苯乙烯的物质的量分数为25%,则氢气的物质的量分数为25%,乙苯的物质的量分数为50%,
故答案为:25%;50%;
②乙苯的平衡转化率为
| x mol |
| amol |
③C6 H5-CH2 CH3 (g)?C6 H5-CH=CH2 (g)+H2(g)
起始浓度/( mol?L-1):
| a |
| V |
变化浓度/( mol?L-1):
| a |
| 3V |
| a |
| 3V |
| a |
| 3V |
平衡浓度/( mol?L-1):
| 2a |
| 3V |
| a |
| 3V |
| a |
| 3V |
K=
| ||||
|
| a |
| 6V |
故答案为:
| a |
| 6V |
(2)由图可知温度升高氢气平衡的物质量分数在增加,平衡正向移动,正反应为吸热反应,故答案为:>;
(3)在相同温度下,若反应体系中加入稀释剂,根据平衡移动原理,向计量数增加的方向移动,即正向移动,转化率增加,故答案为:>;
(4)由盖斯定律可知,目标反应可由①式+②式+③式得,所以反应热为△H1+△H2+△H3,故答案为△H1+△H2+△H3.
点评:本题考盖斯定律的应用,化学平衡常数的计算,以及三行式来求反应的转化率,难度中等.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,11.2LH2O含有的分子数为0.5NA |
| B、含有NA个氦原子的氦气在标准状况下的体积约为l1.2L |
| C、25℃、l标准大气压下,64gSO2中含有的原子数为3NA |
| D、在常温常压下,11.2LCl2含有的分子数为0.5NA |
下列有关环境问题的说法中错误的是( )
| A、减少化石燃料的使用能减轻温室效应 |
| B、酸雨是指PH值小于7的雨水 |
| C、对煤炭进行脱硫处理后再做燃料能有效减少酸雨 |
| D、使用无氟冰箱可减缓臭氧空洞的产生 |
短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说法正确的是( )
| A、B与A只能组成BA3化合物 |
| B、C、D、E形成的化合物与稀硫酸可能发生氧化还原反应 |
| C、A、B、C形成的化合物一定不能发生水解反应 |
| D、E的氧化物对应的水化物一定有强的氧化性 |
