题目内容
下列有关环境问题的说法中错误的是( )
| A、减少化石燃料的使用能减轻温室效应 |
| B、酸雨是指PH值小于7的雨水 |
| C、对煤炭进行脱硫处理后再做燃料能有效减少酸雨 |
| D、使用无氟冰箱可减缓臭氧空洞的产生 |
考点:常见的生活环境的污染及治理
专题:化学应用
分析:A.温室效应主要原因是温室气体二氧化碳的排放;
B.酸雨是指PH值小于5.6的雨水;
C.酸雨形成的主要原因是二氧化硫;
D.氟利昂能破坏臭氧层.
B.酸雨是指PH值小于5.6的雨水;
C.酸雨形成的主要原因是二氧化硫;
D.氟利昂能破坏臭氧层.
解答:
解:A.减少化石燃料的使用,能减少温室气体二氧化碳的排放,能减轻温室效应,故A正确;
B.酸雨是指PH值小于5.6的雨水,故B错误;
C.酸雨形成的主要原因是二氧化硫,故对煤炭进行脱硫处理后再做燃料能有效减少酸雨,故C正确;
D.氟利昂能破坏臭氧层,用无氟冰箱可减缓臭氧空洞的产生,故D正确;
故选B.
B.酸雨是指PH值小于5.6的雨水,故B错误;
C.酸雨形成的主要原因是二氧化硫,故对煤炭进行脱硫处理后再做燃料能有效减少酸雨,故C正确;
D.氟利昂能破坏臭氧层,用无氟冰箱可减缓臭氧空洞的产生,故D正确;
故选B.
点评:本意考查了温室效应、酸雨、臭氧层空洞、等环境问题,难度不大.

练习册系列答案
相关题目
物质的量浓度相同的下列溶液:HCl、H2SO4、CH3COOH,导电能力由强到弱的顺序是( )
| A、HCl=H2SO4>CH3COOH |
| B、HCl>H2SO4>CH3COOH |
| C、H2SO4>HCl>CH3COOH |
| D、HCl=H2SO4=CH3COOH |
 如图所示装置I是一种可充电电池,装置Ⅱ为电解池.离子交换膜只允
如图所示装置I是一种可充电电池,装置Ⅱ为电解池.离子交换膜只允许Na+通过,充放电的化学方程式为2Na2S2+NaBr3
| 充电 |
| 放电 |
| A、当有0.01mol Na+通过离子交换膜时,b电极上析出112mL的气体 |
| B、负极反应为3Br--2e-=Br3- |
| C、闭合K后,b电极附近的pH变小 |
| D、闭合K后.a电极上有氯气产生 |
短周期元素W、X、Y、Z的原子序数依次增大.W元素的最外层电子数是内层电子数的3倍;1mol X单质能与冷水反应,在标准状况下生成11.2L H2;Y原子最外层电子数等于其周期序数;Z负二价阴离子的电子层结构与Ar原子相同.下列说法不正确的是( )
| A、上述四种元素的原子半径大小为X>Y>Z>W |
| B、化合物X2W2中存在两种类型的化学键 |
| C、依据最高价氧化物对应水化物的碱性强弱可以比较X和Y的金属性强弱 |
| D、W、Z的氢化物的沸点:HmW<HmZ |
元素X、Y可形成XY2型离子化合物,它们的原子序数可能为( )
| A、6,8 | B、12,9 |
| C、16,8 | D、11,16 |
常温下,0.1mol/L某一元酸(HA)溶液中
=1×10-8,下列叙述正确的是( )
| c(OH-) |
| c(H+) |
| A、溶液中水电离出的c(H+)=10-10mol/L |
| B、溶液中c(H+)+c(A-)=0.1mol/L |
| C、溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大 |
| D、与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为 c(A-)>c(Na+)>c(OH-)>c(H+) |
对于电解质溶液,下列说法不正确的是( )
| A、常温下,pH=2的氯水中:c(Cl-)+c(ClO-)+c(OH-)=0.01mol/L |
| B、用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+═Cu2++2H2O |
| C、MgCO3可以除去MgCl2酸性溶液中的Fe3+ |
| D、在pH=1的溶液中,NH4+、K+、ClO-、Cl-可以大量共存 |
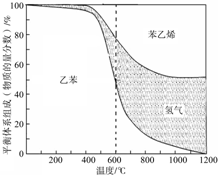 苯乙烯是重要的基础有机原料.工业中用乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式为:
苯乙烯是重要的基础有机原料.工业中用乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式为: