题目内容
3.将0.5mol SO2和0.2mol O2置于密闭容器中发生反应:2SO2+O2$?_{催化剂}^{高温}$ 2SO3.下列关于该反应的说法正确的是( )| A. | 最终可生成0.4 mol SO3 | |
| B. | 当v正(O2)=v逆(SO2)=0时一定达化学平衡 | |
| C. | 升高温度反应速率减小 | |
| D. | 缩小体积增大压强反应速率增大 |
分析 A.该反应为可逆反应,氧气的物质的量为0.2mol,则生成三氧化硫的物质的量一定小于0.4mol;
B.达到平衡状态时反应速率不等于0;
C.升高温度后反应速率一定增大;
D.缩小体积增大压强,反应速率会增大.
解答 解:A.将0.5mol SO2和0.2mol O2置于密闭容器中发生反应:2SO2+O2$?_{催化剂}^{高温}$ 2SO3,该反应为可逆反应,则氧气不可能完全反应,所以生成三氧化硫的物质的量一定小于0.4mol,故A错误;
B.当v正(O2)=v逆(SO2)时一定达化学平衡,但是反应速率不等于0,故B错误;
C.温度升高,反应速率会增大,故C错误;
D.该反应中有气体参与,则缩小体积增大压强,反应速率会增大,故D正确;
故选D.
点评 本题考查了化学平衡的影响因素,题目难度不大,明确影响化学平衡的因素为解答关键,注意掌握可逆反应特点及影响化学反应速率的因素.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与浓度和反应温度有关,下列各组物质
①Cu与HNO3 ②Cu与FeCl3 ③Zn与H2SO4 ④Fe与HCl,由于浓度不同而发生不同反应的是( )
①Cu与HNO3 ②Cu与FeCl3 ③Zn与H2SO4 ④Fe与HCl,由于浓度不同而发生不同反应的是( )
| A. | ①② | B. | ①③ | C. | ③④ | D. | ①②③④ |
4.下列说法中正确的是( )
| A. | CH4、C2H2、HCN都是含有极性键的非极性分子 | |
| B. | CO2与SO2的空间构型相似,都是非极性分子 | |
| C. | HC≡C一CH(CH3)-CH=CH一CH3分子中含有1个手性碳原子 | |
| D. | 无机含氧酸分子中有几个氢原子,它就属于几元酸 |
11.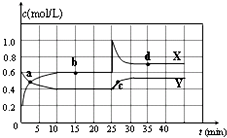 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入 一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入 一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入 一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入 一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( )| A. | 图中的两条曲线,X是表示NO2浓度随时间的变化曲线 | |
| B. | 前10 min内用v(N2O4)表示的化学反应速率为0.2 mol/(L•min) | |
| C. | 25 min时,NO2转变为N2O4的反应速率增大,不可能是将密闭容器的体积缩小为1L引起的 | |
| D. | 前10 min内用v(NO2)表示的化学反应速率为0.04 mol/(L•min) |
18.将固体NH4I置于某体积不变的密闭容器中,在某温度下发生下列反应:①NH4I(s)?NH3(g)+HI(g);②2HI(g)?H2(g)+I2(g),平衡时,c(HI)=6mol•L-1,c(H2)=1mol•L-1,则此温度下反应①的平衡常数为( )
| A. | 36 | B. | 49 | C. | 48 | D. | 64 |
8.下列表达方式错误的是( )
| A. |  | B. |  | C. | ${\;}_{8}^{18}$O | D. |  |
15.某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如下:m CeO2$→_{①}^{太阳能}$(m-x)CeO2•x Ce+x O2(m-x)CeO2•xCe+xH2O+xCO2$→_{②}^{900℃}$mCeO2+xH2+xCO下列说法不正确的是( )
| A. | 该过程中CeO2没有消耗 | |
| B. | 该过程实现了太阳能向化学能的转化 | |
| C. | 如图中△H1=△H2+△H3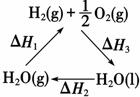 | |
| D. | 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-═CO2+2H2O |
13.在无色透明的溶液中可以大量共存的离子组是( )
| A. | H+、NH4+、Fe2+、NO3- | B. | OH-、Cl-、Na+、NH4+ | ||
| C. | NH4+、K+、Cl-、NO3- | D. | Fe2+、SO42-、OH-、Cl- |
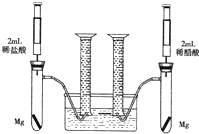 某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)
某化学小组为比较盐酸和醋酸的酸性强弱,设计了如下实验方案.装置如图(夹持仪器略)