题目内容
15.某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO.其过程如下:m CeO2$→_{①}^{太阳能}$(m-x)CeO2•x Ce+x O2(m-x)CeO2•xCe+xH2O+xCO2$→_{②}^{900℃}$mCeO2+xH2+xCO下列说法不正确的是( )| A. | 该过程中CeO2没有消耗 | |
| B. | 该过程实现了太阳能向化学能的转化 | |
| C. | 如图中△H1=△H2+△H3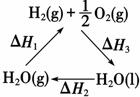 | |
| D. | 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-═CO2+2H2O |
分析 A、根据题干反应方程式写出总反应:H2O+CO2→H2+CO+O2,反应中CeO2没有消耗;
B、该过程中在太阳能作用下将H2O、CO2转变为H2、CO;
C、根据盖斯定律及图中转化关系进行分析;
D、CO在负极上放电,注意碱性环境对负极反应的影响.
解答 解:A、通过太阳能实现总反应H2O+CO2→H2+CO+O2可知:CeO2没有消耗,CeO2为催化剂,故A正确;
B、该过程中在太阳能作用下将H2O、CO2转变为H2、CO,所以把太阳能转变成化学能,故B正确;
C、由图中转化关系及据盖斯定律可知:-△H1为正值,△H2+△H3为负值,则-△H1=△H2+△H3,故C错误;
D、CO在负极失电子生成CO2,在碱性条件下再与OH-生成CO32-,故负极反应式应为:CO+4OH--2e-═CO32-+2H2O,故D错误;
故选CD.
点评 本题考查了原电池原理、盖斯定律的应用及催化剂的判断,题目难度中等,注意明确盖斯定律的含义及利用盖斯定律求算反应热的方法,明确原电池工作原理.

练习册系列答案
相关题目
15.下列反应的离子方程式中,书写正确的是( )
| A. | 钠跟水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 铁粉跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液跟稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙跟盐酸反应:CO32-+2H+═H2O+CO2↑ |
3.将0.5mol SO2和0.2mol O2置于密闭容器中发生反应:2SO2+O2$?_{催化剂}^{高温}$ 2SO3.下列关于该反应的说法正确的是( )
| A. | 最终可生成0.4 mol SO3 | |
| B. | 当v正(O2)=v逆(SO2)=0时一定达化学平衡 | |
| C. | 升高温度反应速率减小 | |
| D. | 缩小体积增大压强反应速率增大 |
20.A-H及X均为中学化学常见物质,X是一种金属单质,A、B是非金属单质且A在常温下为气体.甲是短周期元素形成的盐,且是某种消毒液的有效成分.它们在一定条件下有如下转化关系(图中条件均已略去).
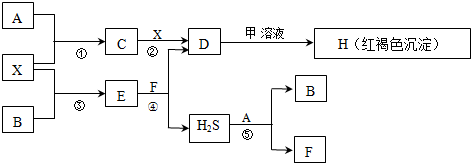
试回答下列问题:
(1)鉴定D中阳离子(不考虑H+)的操作和现象是向少量D溶液中滴入几滴KSCN溶液,无现象,再加入H2O2溶液,溶液显红色.说明D中有Fe2+离子
(2)A与B在一定条件下反应生成一种原子个数比为1:1的分子Y,Y分子中各原子皆达8电子结构,则Y的电子式为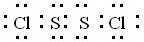 .
.
(3)甲能使D迅速转化为H,甲是NaClO(写化学式),此时甲溶液表现的性质是
氧化性和碱性.将甲溶液与溶液C混合,也能迅速生成H,写出反应的离子方程式Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO.
(4)反应⑤的化学方程式为H2S+Cl2=S↓+2HCl.
(5)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液部分pH与c(S2-)关系如下表(忽略溶液体积的变化、H2S的挥发).
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1 Mn2+、0.10mol•L-1 H2S,当溶液pH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13].

试回答下列问题:
(1)鉴定D中阳离子(不考虑H+)的操作和现象是向少量D溶液中滴入几滴KSCN溶液,无现象,再加入H2O2溶液,溶液显红色.说明D中有Fe2+离子
(2)A与B在一定条件下反应生成一种原子个数比为1:1的分子Y,Y分子中各原子皆达8电子结构,则Y的电子式为
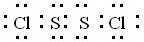 .
.(3)甲能使D迅速转化为H,甲是NaClO(写化学式),此时甲溶液表现的性质是
氧化性和碱性.将甲溶液与溶液C混合,也能迅速生成H,写出反应的离子方程式Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO.
(4)反应⑤的化学方程式为H2S+Cl2=S↓+2HCl.
(5)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液部分pH与c(S2-)关系如下表(忽略溶液体积的变化、H2S的挥发).
| pH | 1 | 3 | 5 | 7 | 9 | 11 | 13 |
| c(S2-) | 1.4×10-19 | 1.4×10-15 | 1.4×10-11 | 6.7×10-7 | 1.9×10-5 | 1.3×10-3 | 5.7×10-2 |
②某溶液含0.020mol•L-1 Mn2+、0.10mol•L-1 H2S,当溶液pH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13].
7.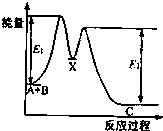 反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )
反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )
 反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )
反应A+B→C分两步进行:①A+B→X;②X→C.反应过程中能量变化如图所示.下列有关叙述正确的是( )| A. | E2表示反应X→C的反应热 | |
| B. | A+B→C此反应放热 | |
| C. | X是反应A+B→C的催化剂 | |
| D. | 加入催化剂可改变反应A+B→C的反应热 |
4.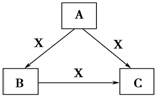 A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
 A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )
A、B、C、X均为中学化学常见物质,一定条件下有如图所示转化关系(其他产物已略去),下列说法错误的是( )| A. | 若A、B、C均为焰色反应呈黄色的化合物,则X可为CO2 | |
| B. | 若X为KOH溶液,则A可为AlCl3 | |
| C. | 若X为O2,则A可为硫化氢 | |
| D. | 若X为Cl2,则C可为FeCl3 |
 回答下列问题
回答下列问题
