题目内容
8.下列关于离子键、共价键的叙述中正确的是( )| A. | 非极性键只存在于双原子的单质分子(如Cl2)中 | |
| B. | 在共价化合物里,可能存在离子键 | |
| C. | 在离子化合物里,只存在离子键,没有共价键 | |
| D. | 化学反应的实质是旧键的断裂,新键的形成 |
分析 A、非极性键可能存在离子化合物或共价化合物中;
B、只含共价键的化合物是共价化合物;
C、含有离子键的化合物为离子化合物,离子化合物中可能含有共价键;
D、化学反应中一定有物质的变化.
解答 解:A、非极性键可能存在离子化合物或共价化合物中,如过氧化钠、HC≡CH,故A错误;
B、只含共价键的化合物是共价化合物,所以不可能存在离子键,故B错误;
C、含有离子键的化合物为离子化合物,离子化合物中可能含有共价键,如KOH,故C错误;
D、因化学反应中一定有物质的变化,则化学反应实质是旧键断裂、新键形成,故D正确;
故选D.
点评 本题考查了化学键与物质的关系,明确物质的组成结构是解本题关键,再结合概念来分析解答.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列各装置图的叙述中,错误的是( )


| A. | 实验室用装置①蒸馏石油 | |
| B. | 装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| C. | 装置③可用于制备氢氧化亚铁并观察其颜色 | |
| D. | 装置④是电解精炼铜,b极为粗铜,发生氧化反应 |
19.下列表示物质结构的化学用语正确的是( )
| A. | 二氧化碳的结构式:O=C=O | B. | HF的电子式: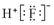 | ||
| C. | Cl-离子的结构示意图: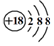 | D. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl |
16.下列对晶体的描述不符合科学依据的是( )
| A. | NaCl晶体中Na+和Cl-之间存在离子键,使得其熔沸点较高 | |
| B. | 金刚石晶体中碳原子以共价键方式形成了立体网状结构,熔沸点高、硬度大 | |
| C. | 足球烯分子间存在分子间作用力,其笼状结构分子使得其具有独特的性能 | |
| D. | 金属钠属于金属晶体,能导电、传热,有延展性,硬度大 |
3.设NA为阿伏加德罗常数的值,下列说法中不正确的是( )
| A. | 1molC2H4Cl2中含有共用电子对数目为7NA | |
| B. | 标准状况下,44.8 L丙三醇与足量金属钠反应,生成气体的分子数为3NA | |
| C. | 20℃时,1 mol己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA | |
| D. | 15g甲基正离子(CH3+)所含有的电子数是8NA |
13.加拿大阿尔贡天文台在星际空间发现了HC9N链状分子,其结构为:HC≡C-C≡C-C≡C-C≡C-C≡N,这是人类迄今发现的最重星际有机分子,有关该分子的说法不正确的是( )
| A. | 该物质是有机物 | B. | 该分子中含有9个σ键和10个π键 | ||
| C. | 该分子可发生加成反应 | D. | 该分子中所有原子在同一直线上 |
20.将CO2气体通入下列溶液中,无明显现象的是( )
| A. | NaAlO2溶液 | B. | Na2SiO3溶液 | C. | 漂白粉溶液 | D. | CaCl2 |
17. 甲苯(
甲苯( 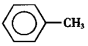 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛( 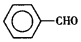 )、苯甲酸(
)、苯甲酸( 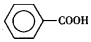 )等产品.表列出了有关物质的部分物理性质,请回答:
)等产品.表列出了有关物质的部分物理性质,请回答:
注:甲苯、苯甲醛、苯甲酸三者互溶.
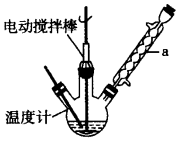
实验室可用如图装置模拟制备苯甲醛.实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时.
(1)装置a的名称是冷凝管,主要作用是冷凝回流,防止甲苯的挥发而降低产品产率.
(2)三颈瓶中发生反应的化学方程式为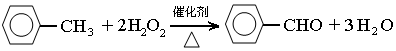
(3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是H2O2在较高温度时分解速度加快,使实际参加反应的H2O2减少,影响产量.
(4)反应完毕后,反应混合液经过自然冷却至室温后,还应经过过滤、蒸馏(填操作名称)等操作,才能得到苯甲醛粗产品.
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸,若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是dacb(按步骤顺序填字母).
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合震荡.
 甲苯(
甲苯(  )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(  )、苯甲酸(
)、苯甲酸(  )等产品.表列出了有关物质的部分物理性质,请回答:
)等产品.表列出了有关物质的部分物理性质,请回答:| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
实验室可用如图装置模拟制备苯甲醛.实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸(作为溶剂)和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时.
(1)装置a的名称是冷凝管,主要作用是冷凝回流,防止甲苯的挥发而降低产品产率.
(2)三颈瓶中发生反应的化学方程式为

(3)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是H2O2在较高温度时分解速度加快,使实际参加反应的H2O2减少,影响产量.
(4)反应完毕后,反应混合液经过自然冷却至室温后,还应经过过滤、蒸馏(填操作名称)等操作,才能得到苯甲醛粗产品.
(5)实验中加入过量过氧化氢且反应时间较长,会使苯甲醛产品中产生较多的苯甲酸,若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是dacb(按步骤顺序填字母).
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.加入适量碳酸氢钠溶液混合震荡.
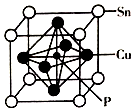 磷化铜(Cu3P2)用于制造磷青铜、磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件.
磷化铜(Cu3P2)用于制造磷青铜、磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件.