题目内容
20.如图是一个化学过程的示意图.
(1)请回答图中甲池是原电池装置,其中OH-移向正极(填“正”或“负”)
(2)写出通入CH3OH的电极反应式是CH3OH-6e-+8OH-=CO32-+6H2O
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为A极(填“A”或“B”),并写出此电极反应的电极反应式4H2O-4e-=O2↑4H+.
(4)乙池中反应的离子方程式为4Ag++2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4H+.
(5)当乙池中B(Ag)极的质量增加2.70g时,乙池的pH是1(若此时乙池中溶液的体积为250mL);此时丙池某电极析出0.80g某金属,则丙中的某盐溶液可能是BD(填序号)
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3.
分析 (1)燃料电池属于原电池,原电池放电时,溶液中阳离子向正极移动,阴离子向负极移动;
(2)燃料电池中燃料失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水;
(3)乙池有外接电源是电解池,阳极上水得电子生成氧气和氢离子,阴极上银离子放电,酸性溶液使紫色石蕊试液变红,根据电极附近溶液的酸碱性变化确定溶液变红的电极;
(4)电解硝酸银溶液时,银离子得电子生成银、水失电子生成氧气和氢离子,据此写出离子方程式;
(5)根据银和氢离子关系式计算氢离子浓度,从而确定溶液的pH,阴极上析出金属,则在金属活动性顺序表中金属元素处于H元素后,根据串联电池中转移电子数相等知,丙中析出金属元素需要的电子等于或小于乙池中转移电子数,据此确定含有的金属元素.
解答 解:(1)燃料电池是化学能转变为电能的装置,属于原电池,燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,原电池放电时,电解质溶液中氢氧根离子向负极移动,即向投放甲醇的电极移动,故答案为:原电池;正;
(2)该燃料电池中,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
(3)乙池有外接电源属于电解池,连接原电池正极的A是阳极,连接原电池负极的B是阴极,电解硝酸银溶液时,A电极上水得电子生成氧气和氢离子,溶液呈酸性,加热紫色石蕊试液呈红色,电极反应式为4H2O-4e-=O2↑4H+,
故答案为:A,4H2O-4e-=O2↑4H+;
(4)电解硝酸银溶液时,银离子得电子生成银、水失电子生成氧气和氢离子,离子方程式为4Ag++2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4H+,
故答案为:4Ag++2H2O$\frac{\underline{\;电解\;}}{\;}$4Ag+O2↑+4H+;
(5)当乙池中B(Ag)极的质量增加2.70g时,设氢离子浓度为xmol/L,
4Ag++2H2O=4Ag+O2↑+4H+;
432g 4mol
2.70g 0.25xmol
x=0.1,则溶液的pH=1,阴极上析出金属,则在金属活动性顺序表中金属元素处于H元素后,根据串联电池中转移电子数相等知,丙中析出金属元素需要的电子等于或小于乙池中转移电子数,据此确定含有的金属元素,析出2.70g时转移电子是0.025mol,
A、硫酸镁中镁元素处于H元素前,所以阴极上不析出金属单质,故错误;
B、电解硫酸铜溶液时,阴极上析出0.8g铜需要转移电子0.025mol,故正确;
C、氯化钠中钠元素处于氢元素前,所以阴极上不析出金属单质,故错误;
D、电解硝酸银溶液时,阴极上析出0.80g银需要转移电子0.0074mol<0.025mol,故正确;
故选BD;
故答案为:1;BD.
点评 本题考查了原电池和电解池原理,注意(5)题中,丙中析出金属元素需要的电子等于或小于乙池中转移电子数,为易错点.

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案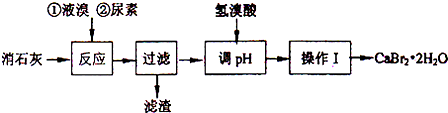
溴化钙的部分溶解度数值如下:
| 温度 | 0℃ | 10℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| 溶解度(g) | 125 | 132 | 143 | 213 | 278 | 295 | 312 |
(2)过滤所需的玻璃仪器有玻璃棒、烧杯、漏斗.
(3)加入氢溴酸调pH的作用是除去过量的氢氧化钙.
(4)操作I包括蒸发浓缩、冷却结晶、过滤、冰水洗涤、干燥.
(5)“二氧化硫法”制备的氢溴酸粗品中常含有少量的溴和硫酸;请选用所提供的试剂,试写出检验氢溴酸粗品中是否含有SO42-的实验方案:取少量氢溴酸粗产品与试管中,滴加少量稀盐酸,再加入BaCl2溶液,若产生白色沉淀,说明含有SO42-;否则不含SO42-.
①冰雪融化 ②KMnO4分解制O2 ③铝与氧化铁的反应 ④钠与水反应 ⑤二氧化碳与灼热木炭反应 ⑥碘的升华 ⑦Ba(OH)2•8H2O和NH4Cl反应.
| A. | ②⑥⑦ | B. | ②⑤⑦ | C. | ①②⑤⑥⑦ | D. | ③④ |
| A. | 凡是放热反应都是自发的,吸热反应都是非自发的 | |
| B. | 常温下,C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | 任何能使熵值增大的过程都能自发进行 | |
| D. | 反应物和生成物所具有的总焓决定了反应是否能自发进行 |
| A. | 达到化学平衡时,5v正(O2)=4v逆(NO) | |
| B. | 若单位时间内生成x mol NO,同时消耗x mol NH3,则可确定反应达到平衡状态 | |
| C. | 达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率也减小 | |
| D. | 化学反应速率的关系是2v正(NH3)=3v正(H2O) |