题目内容
15.将适量铁粉放入Fe2(SO4)3溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等.则已经反应的Fe3+和未反应的Fe3+物质的量之比为( )| A. | 2:3 | B. | 3:2 | C. | 1:2 | D. | 2:1 |
分析 铁粉放入Fe2(SO4)3溶液中发生反应生成硫酸亚铁,根据方程式设反应的三价铁的量,就可以获得生成的亚铁的量,进而获得未反应的Fe3+的物质的量,得到两者的比值,由此分析解答.
解答 解:铁粉放入Fe2(SO4)3溶液中,发生的反应为:Fe+2Fe3+=3Fe2+,已反应的Fe3+的物质的量为n,则
Fe+2Fe3+=3Fe2+,
2 3
n 1.5n
溶液中的Fe3+和Fe2+浓度相等,所以,未反应的Fe3+的物质的量为1.5n,所以已反应的Fe3+和未反应的Fe3+的物质的量之比=n:1.5n=2:3,
故选A.
点评 本题是一道关于三价铁和亚铁之间相互转化的题目,要求学生学会利用化学方程式解答问题的能力,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.在化学学习中常可根据已知的实验事实,对某些物质的化学性质作出推测,请判断下列推测合理的是( )
| A. | 从红热的铜丝能在氯气中燃烧,推测红热的铁丝也能在氯气中燃烧 | |
| B. | 从碘单质使淀粉试液变蓝,推测 I-也能使淀粉试液变蓝 | |
| C. | 从Fe能从CuSO4溶液中置换出Cu,推测Na也能从CuSO4溶液中置换出Cu | |
| D. | 从二氧化碳通入Ca(OH)2溶液能产生白色沉淀的事实,推测二氧化碳通入CaCl2溶液也能产生白色沉淀 |
16.在1mol•L-1的NaOH溶液100mL中,通入1.68L(STP)SO2气体后,在溶液中存在的溶液是( )
| A. | Na2SO3和NaHSO3 | B. | Na2SO3和NaOH | C. | Na2SO3 | D. | NaHSO3 |
3.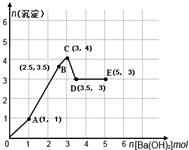 向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )
向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )
 向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )
向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )| A. | O→A:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| B. | A→B:2Al3++3SO42-+3Ba2++6OH2-=3BaSO4↓+2Al(OH)3↓ | |
| C. | B→C:NH4++SO42-+Ba2++OH-=BaSO4↓+NH3•H2O | |
| D. | D→E:NH4++OH-=NH3•H2O |
10.下列关于氧化还原反应的叙述中,正确的是( )
| A. | 有单质参加的反应一定是氧化还原反应 | |
| B. | 一种物质被氧化,必有另一种物质被还原 | |
| C. | 化学反应中,Mg失去2个电子,Al失去3个电子,因此还原性:Al>Mg | |
| D. | 2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$ 2FeCl3; Fe+S $\frac{\underline{\;\;△\;\;}}{\;}$ FeS 由此可以判断氧化性:Cl2>S |
20.在恒温恒容的密闭容器中进行反应:X(g)+Y(g)?Z(g),若反应物X的浓度从1mol/L降到0.4mol/L需10s,那么反应物X的浓度由0.4mol/L降到0.1mol/L所需的反应时间为( )
| A. | 5s | B. | 大于5s | C. | 小于5s | D. | 无法判断 |
7.称取两等份铝粉,第一份加入足量的盐酸,第二份加入足量的烧碱,若同温同压下放出相同体积的气体,则消耗的HCl和NaOH的物质的量之比为( )
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 3:1 |
4.某有机物分子中有 n 个CH 2,m 个  ,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )
,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )
 ,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )
,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )| A. | m-a | B. | n+m+a | C. | m+1-a | D. | m+2-a |
5.下列说法不正确的是( )
| A. | 光导纤维中所用材料为二氧化硅,而硅可用作半导体材料 | |
| B. | 丁达尔效应可以区分溶液与胶体 | |
| C. | CO2、SiO2都是酸性氧化物,都能溶于水和碱,都不能和任何酸反应 | |
| D. | 金属钠、镁失火都不能用二氧化碳灭火 |