题目内容
2.下列热化学方程式或离子方程式中,正确的是( )| A. | 0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| B. | 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
分析 A、0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合,则铵根离子、铝离子、硫酸根离子、钡离子、氢氧根离子的物质的量之比是:1:1:2:2:4,据此反应判断;
B、0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,所以生成2mol氨气放出的热量大于38.6kJ;
C、燃烧热指在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热.单位为kJ/mol,生成的水应为液态;
D、燃烧热是指燃烧1mol物质生成稳定的产物所放出的热量,相同条件下的同一可逆反应,正逆反应反应热数值相等,符号相反.
解答 解:A.0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合,则铵根离子、铝离子、硫酸根离子、钡离子、氢氧根离子的物质的量之比是:1:1:2:2:4,所以离子方程式为:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O,故A正确;
B.0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,所以N2(g)+3H2(g)?2NH3(g),焓变代表的是生成2mol氨气放出的热量,则放出的热量大于38.6kJ,故B错误;
C.H2与O2发生反应过程的燃烧热应该是1molH2燃烧生成液态水放出的热量,故C错误;
D.燃烧热是指燃烧1mol物质生成稳定的产物所放出的热量,CO(g)的燃烧热是283.0 kJ•mol-1,即2CO(g)+O2(g)=2CO2(g)△H=-566.0 kJ•mol-1,互为可逆反应的过程焓变的符号相反,数值相等,所以2CO2(g)=2CO(g)+O2(g)△H=+566.0 kJ•mol-1,故D错误.
故选A.
点评 本题主要考查反应热、离子方程式、可逆反应,难度较大,注意A选项清楚反应过程,根据反应物的量书写离子方程式,为易错点、难点.

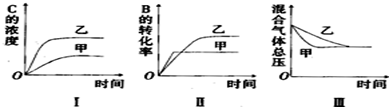
下列判断正确的是( )
| A. | 图I研究的可能是不同催化剂对反应的影响,且乙使用的催化剂效率较高 | |
| B. | 图Ⅱ研究的可能是压强对反应的影响,且甲的压强较高 | |
| C. | 图Ⅱ研究的可能是温度对反应的影响,且甲的温度较高 | |
| D. | 图Ⅲ研究的可能是不同催化剂对反应的影响,且乙使用的催化剂效率较高 |
| A. | Ca(OH)2 溶液 | B. | 饱和NaCl溶液 | C. | 自来水 | D. | NaOH溶液 |
| A. | RCl2 | B. | R3O4 | C. | R(OH)3 | D. | HRO3 |
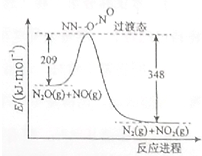 (1)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为NH4NO3$\stackrel{△}{?}$N2O+2H2O,平衡常数表达式为K=c(N2O)×c2(H2O);若有1mol硝酸铵完全分解,转移的电子数为4mol.
(1)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为NH4NO3$\stackrel{△}{?}$N2O+2H2O,平衡常数表达式为K=c(N2O)×c2(H2O);若有1mol硝酸铵完全分解,转移的电子数为4mol.
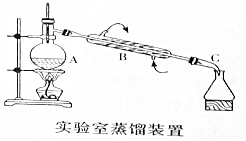 如图是用自来水制备蒸馏水的实验装置图.
如图是用自来水制备蒸馏水的实验装置图.