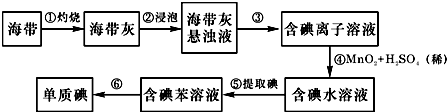
题目内容
7.下列各组顺序排列不正确的是( )| A. | 熔点:SiO2>NaCl>CO2 | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 金属性:Na<Mg<Al | D. | 酸性强弱:H2SiO3<H2CO3<HNO3 |
分析 A、晶体熔沸点:原子晶体>离子晶体>分子晶体;
B、元素的非金属性越强,其氢化物的稳定性越强;
C、同周期从左到右金属性减弱;
D、元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答 解:A、晶体熔沸点:原子晶体>离子晶体>分子晶体,所以熔点:SiO2>NaCl>CO2,故A正确;
B、元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>S>P,所以氢化物的稳定性HCl>H2S>PH3,故B正确;
C、同周期从左到右金属性减弱,所以金属性:Na>Mg>Al,故C错误;
D、元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性:Si<C<N,所以酸性强弱:H2SiO3<H2CO3<HNO3,故D正确;
故选C.
点评 本题考查元素周期律,侧重考查学生分析推断能力,知道非金属性强弱判断方法、晶体熔沸点高低判断方法,注意最高价氧化物对应水化物的酸性强弱的判断.

练习册系列答案
相关题目
18.中华语言博大精深,下列词语中,其含意是物理变化的是( )
| A. | 蜡炬成灰 | B. | 滴水穿石 | C. | 百炼成钢 | D. | 曾青得铁 |
15.下列反应的离子方程式正确的是( )
| A. | 大理石与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 在氯化铝溶液中滴加过量的氨水:Al3++4 OH-═[Al (OH)4]- | |
| C. | 在氢氧化钠溶液中通入过量的CO2:2OH-+CO2═CO32-+H2O | |
| D. | 二氧化硅与苛性钠溶液反应:SiO2+2OH-═SiO32-+H2O |
2.在某一化学反应A+3B═2C+D中,反应物A的浓度在20s内由1.0mol/L变成0.2mol/L,则在这20s内用C表示的平均反应速率为( )
| A. | v(C)=0.01 mol/(L•s) | B. | v(C)=0.8 mol/(L•s) | C. | v(C)=0.04 mol/(L•s) | D. | v(C)=0.08 mol/(L•s) |
19.下列各物质中酸性最弱的是( )
| A. | H2SiO3 | B. | HClO4 | C. | H2SO4 | D. | H2CO3 |
16.下列物质中,属于共价化合物的是( )
| A. | MgCl2 | B. | HCl | C. | NH4Cl | D. | Na2O2 |
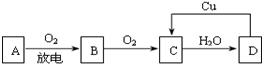

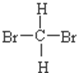 和
和