题目内容
如图为甲乙两个电解池,请回答:
(1)甲池若为用电解原理精炼铜的装置.
A极是 ,电极材料是 ,主要电极反应为 ;
B极是 ,电极材料是 ,主要电极反应为 ,电解质溶液为 .
(2)乙池中若滴入少量酚酞试液,开始一段时间后,Fe极附近呈 色.
(3)若甲槽阴极增重12.8g,则乙槽阳极放出气体在标准状态下的体积为 .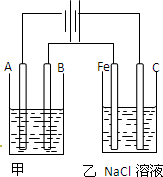
(1)甲池若为用电解原理精炼铜的装置.
A极是
B极是
(2)乙池中若滴入少量酚酞试液,开始一段时间后,Fe极附近呈
(3)若甲槽阴极增重12.8g,则乙槽阳极放出气体在标准状态下的体积为

考点:电解原理
专题:
分析:图示是两个串联的电解池,依据电源判断A为阴极,B为阳极,Fe为阴极,C为阳极,
(1)电解精炼粗铜时,粗铜作阳极,纯铜作阴极,电解质溶液为可溶性的铜盐;
(2)乙池中是电解饱和食盐水,根据放电的离子确定现象;
(3)甲池是精炼铜,增重12.8g是铜的质量,根据电解反应过程中电极上的电子守恒计算.
(1)电解精炼粗铜时,粗铜作阳极,纯铜作阴极,电解质溶液为可溶性的铜盐;
(2)乙池中是电解饱和食盐水,根据放电的离子确定现象;
(3)甲池是精炼铜,增重12.8g是铜的质量,根据电解反应过程中电极上的电子守恒计算.
解答:
解:(1)电解精炼粗铜时,粗铜作阳极,纯铜作阴极,电解质溶液为可溶性的铜盐,根据图片知,A是阴极,B是阳极,所以A极材料是纯铜,阴极上铜离子得电子发生还原反应,电极反应式为:Cu2++2e-═Cu,
B是阳极,电极材料是粗铜,阳极上铜失电子发生氧化反应,电极反应式为:Cu-2e-═Cu2+,电解质一般用可溶性的硫酸铜溶,
故答案为:阴极;纯铜;Cu2++2e-═Cu;阳极;粗铜;Cu-2e-═Cu2+;CuSO4溶液;
(2)乙池电解NaCl溶液,阴极反应为:2H2O+2e-═H2↑+20H-,滴加酚酞溶液后,阴极溶液变红,
故答案为:红;
(3)串联电路中转移电子相等,若甲槽阴极增重12.8g,由电极方程式Cu2++2e-═Cu可知,阴极上得到电子的物质的量=
=0.2mol,乙槽阳极电极反应为:2Cl--2e-=Cl2↑,根据转移电子相等得,放出气体在标准状况下的体积=
×22.4L/mol=2.24L,
故答案为:2.24L.
B是阳极,电极材料是粗铜,阳极上铜失电子发生氧化反应,电极反应式为:Cu-2e-═Cu2+,电解质一般用可溶性的硫酸铜溶,
故答案为:阴极;纯铜;Cu2++2e-═Cu;阳极;粗铜;Cu-2e-═Cu2+;CuSO4溶液;
(2)乙池电解NaCl溶液,阴极反应为:2H2O+2e-═H2↑+20H-,滴加酚酞溶液后,阴极溶液变红,
故答案为:红;
(3)串联电路中转移电子相等,若甲槽阴极增重12.8g,由电极方程式Cu2++2e-═Cu可知,阴极上得到电子的物质的量=
| 12.8g |
| 64g/mol |
| 0.2mol |
| 2 |
故答案为:2.24L.
点评:本题考查了电解池原理,明确阴阳极上发生的反应是解本题关键,再结合转移电子相等分析解答,难度不大.

练习册系列答案
相关题目
 在2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是为( )
在2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是为( )| A、0.5mol |
| B、1.0mol |
| C、2.0mol |
| D、3.0mol |
已知: ,下列叙述不正确的是( )
,下列叙述不正确的是( )
 ,下列叙述不正确的是( )
,下列叙述不正确的是( )| A、反应①中Cl2既作氧化剂又作还原剂 |
| B、反应②中ClO3-作氧化剂 |
| C、两个反应均为氧化还原反应 |
| D、反应②中的离子方程式为:ClO3-+Cl-+6H+=Cl2↑+3H2O |
向2.0L容器中充入2.0molE气体,发生2E(g)?M(g)△H<0反应,反应达平衡时平衡常数K=1.0,则下列说法正确的是( )
| A、反应需25秒达平衡,反应达平衡以E表示反应速率为0.01mol/(L?s) |
| B、若维持其它条件不变,向上述容器中起初加入2.0molM,反应建立平衡,M的转化率为50% |
| C、若维持其它条件不变,再向上述反应平衡中分别加入0.5molE,0.5molM,则平衡向右移动 |
| D、若上述容器为绝热容器,则反应达平衡速率比原平衡速率增大,M浓度也增大 |
一定温度下,对可逆反应A(g)+2B(g)?2C(g)的下列叙述中,说明反应已达平衡的是( )
| A、混合气体的物质的量不再变化 |
| B、v(A):v(B):v(C)=1:2:2 |
| C、C生成的速率与C分解的速率相等 |
| D、单位时间内消耗amolA,同时生成2amolC |
下列实验能达到目的是( )
| A、用加热的方法除去碳酸钠中的碳酸氢钠 |
| B、用蒸馏的方法除去溴水中的Br2 |
| C、向Na2SO3溶液中加入HCl酸化的Ba(NO3)2以检验Na2SO3是否变质 |
| D、将乙醇、浓硫酸混合共热至170℃,将产物通入到酸性KMnO4溶液中检验乙烯的生成 |
下列有机化合物中均含有杂质,除去这些杂质的方法中正确的是( )
| A、苯中含苯酚杂质:加入溴水,过滤 |
| B、乙醛中含乙酸杂质:加入碳酸氢钠溶液洗涤,分液 |
| C、乙烷中含乙烯杂质:通过高锰酸钾酸性溶液洗涤,洗气 |
| D、乙酸乙酯中含乙酸杂质:加入碳酸钠溶液洗涤,分液 |



