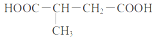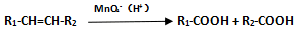题目内容
19.若8g甲烷气体完全燃烧生成液态水时放出445.15KJ的热量,请写出其热化方程式CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ•mol-1.分析 n(CH4)=$\frac{8g}{16g/mol}$=0.5mol,完全燃烧生成液态水时放出的热量是445.15kJ,则1mol计算完全燃烧放出890KJ的能量,进而可书写热化学方程式.
解答 解:n(CH4)=$\frac{8g}{16g/mol}$=0.5mol,完全燃烧生成液态水时放出的热量是445.15kJ,则1mol计算完全燃烧放出890KJ的能量,所以热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ•mol-1,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ•mol-1.
点评 本题考查化学反应与能量,为高频考点,侧重于学生的分析、计算能力的考查,注意把握热化学的书写方法,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列除去杂质的方法正确的是( )
| A. | 除去CO2中混有的CO:通入O2点燃 | |
| B. | 除去铜器表面的铜绿[Cu2(OH)2CO3]:用盐酸浸泡,再用清水冲洗 | |
| C. | 除去SO2中混有的HCl,可将气体通入足量的饱和NaHSO3溶液 | |
| D. | 除去粗盐中的MgCl2、CaCl2和Na2SO4,可加入药品顺序:NaOH→Na2CO3→BaCl2→盐酸. |
10. 的同分构体中只有一个支链且能与NaHCO3溶液反应的芳香族化合物有(不考虑立体异构)( )
的同分构体中只有一个支链且能与NaHCO3溶液反应的芳香族化合物有(不考虑立体异构)( )
 的同分构体中只有一个支链且能与NaHCO3溶液反应的芳香族化合物有(不考虑立体异构)( )
的同分构体中只有一个支链且能与NaHCO3溶液反应的芳香族化合物有(不考虑立体异构)( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
7.下列变化中,不需要破坏化学键的是( )
| A. | 氯化氢溶于水 | B. | 碳酸氢钠受热分解 | ||
| C. | 氯化钠熔化 | D. | 碘升华 |
14.下列实验或生产操作中没有新物质生成的反应有几个
①向碘水中加入CCl4后振荡、静置②二氧化氮经加压凝成无色液体③石蜡催化裂化④碘受热后变成碘蒸气⑤照片底片被感光⑥煤的干馏( )
①向碘水中加入CCl4后振荡、静置②二氧化氮经加压凝成无色液体③石蜡催化裂化④碘受热后变成碘蒸气⑤照片底片被感光⑥煤的干馏( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
3.下列事实不能用化学平衡移动原理解释的是( )
| A. | 棕红色NO2加压后颜色先变深后变浅 | |
| B. | 加催化剂,使 N2和H2在一定条件下转化为NH3 | |
| C. | 可用浓氨水和NaOH固体快速制取氨气 | |
| D. | 加压条件下有利于SO2与O2反应生成SO3 |
10.下列有关实验的描述不正确的是( )
| A. | 钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同 | |
| B. | 新制饱和氯水和浓硝酸光照下会有气体产生,其成分中都有氧气 | |
| C. | 次氯酸和过氧化钠都能使品红溶液褪色,其原理是不相同的 | |
| D. | 取两小块铝箔,将其中一片打磨,灼烧均能看到铝箔熔化但不滴落的现象 |
7.设NA表示阿佛加德罗常数值,下列说法正确的是( )
| A. | 500mL0.1mol•L-1的Al2(SO4)3溶液中,含Al3+0.1NA | |
| B. | 36g重氧(18O2)气体所含分子数为NA,占体积为22.4L | |
| C. | 7.8gNa2O2与足量CO2反应,转移电子数为0.1NA | |
| D. | 15g甲基中含有的电子数为8NA |