题目内容
7.下列离子方程式书写不正确的是( )| A. | Fe与稀盐酸反应:Fe+2H+═Fe3++H2↑ | |
| B. | 盐酸与NaOH溶液反应:H++OH-═H2O | |
| C. | CaCO3与稀HNO3反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | BaCl2溶液与Na2SO4溶液反应:Ba2++SO42-═BaSO4↓ |
分析 A.不符合反应客观事实且电荷不守恒;
B.二者反应生成氯化钠和水;
C.二者反应生成硝酸钙和水、二氧化碳;
D.二者反应生成硫酸钠和氯化钡;
解答 解:A.Fe与稀盐酸反应生成二价铁离子,离子方程式:Fe+2H+═Fe2++H2↑,故A错误;
B.盐酸与NaOH溶液反应,离子方程式:H++OH-═H2O,故B正确;
C.CaCO3与稀HNO3反应,离子方程式:CaCO3+2H+═Ca2++CO2↑+H2O,故C正确;
D.BaCl2溶液与Na2SO4溶液反应,离子方程式:Ba2++SO42-═BaSO4↓,故B正确;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意电荷守恒、原子个数守恒,注意反应遵循客观事实.

练习册系列答案
相关题目
17.判断溶液的酸碱性有多种方法.下列溶液中,一定呈碱性的是( )
| A. | 能够使甲基橙呈现黄色 | B. | 溶液的pH>7 | ||
| C. | 溶液中:c(H+)>1×10-7mol•L-1 | D. | 溶液中:c(H+)<c(OH-) |
18.某有机化合物的结构简式如图所示.有关该化合物的叙述不正确的是( )
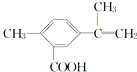

| A. | 该有机物的分子式为C11H12O2 | |
| B. | 1 mol该物质最多能与4 mol H2发生加成反应 | |
| C. | 该有机物能与热的新制氢氧化铜悬浊液反应,生成砖红色沉淀 | |
| D. | 该有机物在一定条件下,可以发生取代、氧化、酯化反应 |
15.元素性质呈周期性变化的根本原因是( )
| A. | 元素的电负性呈周期性变化 | |
| B. | 元素的第一电离能呈周期性变化 | |
| C. | 元素原子的核外电子排布呈周期性变化 | |
| D. | 元素的金属性、非金属性呈周期性变化 |
2.下列无色溶液中能大量共存的离子组是( )
| A. | Na+、K+、HCO3-、NO3- | B. | K+、Fe3+、NO3-、SCN- | ||
| C. | H+、Cr2O72-、SO42-、K+ | D. | H+、Na+、S2O32-、Cl- |
12.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4 L H2O含有分子数为NA | |
| B. | 分子总数为NA的N2气体体积约为22.4 L | |
| C. | 常温常压下,1.6 g CH4含分子数为0.1NA | |
| D. | 常温常压下,3.2g氧气所含氧原子数为0.1NA |
19.某研究性学习小组对铝热反应(以铝和氧化铁反应为例)实验进行研究.已知Al、A12O3、Fe、Fe2O3的熔点、沸点数据如表所示:
请回答下列问题:
(1)铝热反应是氧化还原反应,在反应中金属铝被氧化 (填“氧化”或“还原”).
(2)某同学根据以上数据推测,铝热反应所得到的熔融物中应含有铁、铝两种金属.如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为NaOH溶液.
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下实验方案来验证:取一块该熔融物投入到少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加KSCN溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3.则:该同学的实验方案是否合理:不合理(填“合理”或“不合理”),
若不合理,原因是Fe3+易被Fe、Al还原成Fe2+ (若合理则不用填写).
(4)把7.47g熔融物(主要含有Fe和少量Fe2O3、A1)投入 140mL1.00mol•L-1稀硫酸(足量)充分反应,将反应后的混合液分成两等份,向其中一份滴加KSCN溶液,溶液不变色,向另一份中滴加2.00mol•L-1的NaOH溶液,当加入2.5mL时开始产生沉淀,加入NaOH溶液的体积与所得沉淀质量数据如表:(不考虑空气对沉淀的影响)
①当NaOH溶液体积为70mL时沉淀量达到最大.
②求1.29g沉淀中各成分的质量.(写出计算过程)
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | ------- |
(1)铝热反应是氧化还原反应,在反应中金属铝被氧化 (填“氧化”或“还原”).
(2)某同学根据以上数据推测,铝热反应所得到的熔融物中应含有铁、铝两种金属.如设计一个简单的实验方案证明该熔融物中含有金属铝,则实验所需用的试剂为NaOH溶液.
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下实验方案来验证:取一块该熔融物投入到少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加KSCN溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3.则:该同学的实验方案是否合理:不合理(填“合理”或“不合理”),
若不合理,原因是Fe3+易被Fe、Al还原成Fe2+ (若合理则不用填写).
(4)把7.47g熔融物(主要含有Fe和少量Fe2O3、A1)投入 140mL1.00mol•L-1稀硫酸(足量)充分反应,将反应后的混合液分成两等份,向其中一份滴加KSCN溶液,溶液不变色,向另一份中滴加2.00mol•L-1的NaOH溶液,当加入2.5mL时开始产生沉淀,加入NaOH溶液的体积与所得沉淀质量数据如表:(不考虑空气对沉淀的影响)
| V (NaOH)mL | 20.0 | 40.0 | 60.0 | 80.0 | 100.0 |
| m(沉淀)/g | 1.29 | 3.09 | 4.89 | 5.4 | 5.4 |
②求1.29g沉淀中各成分的质量.(写出计算过程)
16.下列有关化学反应与能量关系的说法错误的是( )
| A. | 弱电解质的电离是一个吸热的过程 | |
| B. | 化学反应中的能量变化不仅仅表现为热量变化 | |
| C. | 反应物的总能量大于生成物的总能量的反应是吸热反应 | |
| D. | 断裂化学键吸收能量,形成化学键放出能量 |
17.四川有丰富的天然气资源.天然气的主要成分是甲烷,还含有一定量的乙烷、丙烷等可燃性气体.下列有关说法不正确的是( )
| A. | 甲烷与丙烷互为同系物 | |
| B. | 甲烷是烃类物质中氢的质量分数最高的化合物 | |
| C. | 甲烷、乙烷、丙烷中的化学键都是极性共价键 | |
| D. | 乙烷和氯气在光照的条件下可发生取代反应,生成多种氯代烃 |