题目内容
16.下列条件下,两瓶气体所含的原子数不一定相等的是( )| A. | 同质量、不同密度的C2H4和C3H6 | B. | 同质量、不同体积的CO和N2 | ||
| C. | 同体积、同密度的N2O和CO2 | D. | 同压强、同体积的CO2和SO2 |
分析 A.二者具有相同的最简式,依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$;
B.CO与N2具有相同的摩尔质量,都是双原子分子;
C.N2O和CO2具有相同的摩尔质量,都是三原子分子,依据m=ρV,n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$判断;
D.同压、同体积的CO2和SO2,温度影响气体分子数目.
解答 解:A.C2H4和C3H6,二者具有相同的最简式CH2,依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$,可知二者质量相同,则具有原子数一定相等,故A不选;
B.CO与N2具有相同的摩尔质量,都是双原子分子,依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$,可知二者质量相同,则具有原子数一定相等,故B不选;
C.N2O和CO2具有相同的摩尔质量,都是三原子分子,依据m=ρV可知同体积、同密度的N2O和CO2质量相等,则依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$,可知二者质量相同,则具有原子数一定相等,故C不选;
D.同压强、同体积的CO2和SO2,温度影响气体分子数目,温度不确定,则无法判断气体分子数关系,含有原子数目不一定相等,故D选;
故选:D.
点评 本题考查原子数的有关计算,以及阿伏加德罗定律及推论,题目难度不大,注意把握物质的量、质量、体积之间的计算公式的运用.

练习册系列答案
相关题目
12.下列有关说法正确的是( )
| A. | 0.1L物质的量浓度为2mol/L的(NH4)2S溶液中含有的S2-数目为0.2×6.02×1023 | |
| B. | 对NaCl溶液和金属钠加热,都会使导电能力增强 | |
| C. | 25℃时,向0.1mol/LCH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 | |
| D. | 用惰性电极电解1L 1mol/L的CuSO4溶液,当阴极析出3.2g铜时,加入0.05mol Cu(OH)2固体可将溶液浓度恢复至元浓度 |
7.第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减少温室气体排放量.
Ⅰ.CO2加氢合成甲醇是合理利用 CO2的有效途径.由 CO2制备甲醇过程可能涉及反应如下:
反应①:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反应②:CO2(g)+H2(g)?CO (g)+H2O(g)△H2
反应③:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ•mol-1,回答下列问题:
(1)反应②的△H2=+41.19 kJ•mol-1,反应 ①自发进行条件是较低温(填“较低温”、“较高温”或“任何温度”).
(2)某温度下,在体积为2L的恒容密闭容器中,按如下方式加入反应物,仅发生反应①.一段时间后达到平衡.
测得甲中CO2和CH3OH(g)的浓度随时间变化如图所示.
①前3min内,平均反应速率v(H2)=0.5mol•L-1•min-1.此温度下该反应的平衡常数为
5.33(结果保留两位小数).
②下列措施中,既能使反应速率加快,又能使n(CH3OH)/n(CO2)增大是D.
A.升高温度 B.充入惰性气体 C.将H2O(g)从体系中分离
D.再充入1mol H2 E.再充入1mol CO2 F.加入催化剂
③反应达到平衡后,若向反应体系再加入CO2(g)、H2(g)、CH3OH(g)、H2O(g)各1mol,化学平衡正向(填“正向”、“逆向”或“不”)移动.
④要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为1.5 mol/L<c≤2 mol/L.
Ⅱ.工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(H2NCOONH4).氨基甲酸铵极易发生:H2NCOONH4+2H2O?NH4HCO3+NH3•H2O,该反应酸性条件下更彻底.25℃,向l L 0.1mol•L-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵.若此时溶液中几乎不含碳元素,则该溶液中 c(NH4+)=0.1mol/L,NH4+水解常数Kh=4×10-9mol/L.
Ⅰ.CO2加氢合成甲醇是合理利用 CO2的有效途径.由 CO2制备甲醇过程可能涉及反应如下:
反应①:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反应②:CO2(g)+H2(g)?CO (g)+H2O(g)△H2
反应③:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ•mol-1,回答下列问题:
(1)反应②的△H2=+41.19 kJ•mol-1,反应 ①自发进行条件是较低温(填“较低温”、“较高温”或“任何温度”).
(2)某温度下,在体积为2L的恒容密闭容器中,按如下方式加入反应物,仅发生反应①.一段时间后达到平衡.
| 容器 | 甲 | 乙 |
| 反应物投入量 | 2mol CO2、6mol H2 | a mol CO2、b mol H2 c mol CH3OH(g)、c mol H2O(g) |

①前3min内,平均反应速率v(H2)=0.5mol•L-1•min-1.此温度下该反应的平衡常数为
5.33(结果保留两位小数).
②下列措施中,既能使反应速率加快,又能使n(CH3OH)/n(CO2)增大是D.
A.升高温度 B.充入惰性气体 C.将H2O(g)从体系中分离
D.再充入1mol H2 E.再充入1mol CO2 F.加入催化剂
③反应达到平衡后,若向反应体系再加入CO2(g)、H2(g)、CH3OH(g)、H2O(g)各1mol,化学平衡正向(填“正向”、“逆向”或“不”)移动.
④要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为1.5 mol/L<c≤2 mol/L.
Ⅱ.工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(H2NCOONH4).氨基甲酸铵极易发生:H2NCOONH4+2H2O?NH4HCO3+NH3•H2O,该反应酸性条件下更彻底.25℃,向l L 0.1mol•L-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵.若此时溶液中几乎不含碳元素,则该溶液中 c(NH4+)=0.1mol/L,NH4+水解常数Kh=4×10-9mol/L.
4.食品卫生与健康密切相关,下列做法会导致食品对人体有害的是( )
①有些食品加工厂将塑化剂添加到食品中 ②石灰水保存鲜鸡蛋
③为了使火腿肠颜色更鲜红,可以多加一些亚硝酸钠④蒸馒头时加入适量纯碱.
①有些食品加工厂将塑化剂添加到食品中 ②石灰水保存鲜鸡蛋
③为了使火腿肠颜色更鲜红,可以多加一些亚硝酸钠④蒸馒头时加入适量纯碱.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
11.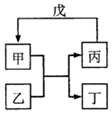 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( )
 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各物质中,不满足如图转化关系的是( ) | 甲 | 乙 | 丙 | 戊 | |
| ① | SiO2 | NaOH | Na2SiO3 | CO2 |
| ② | Fe | H2O | Fe2O3 | H2 |
| ③ | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| ④ | Na2O2 | CO2 | O2 | Na |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ①④ |
1.质量分数不同的两种硫酸溶液,以相同质量混合时,所得混合溶液的密度为ρ1;以相同体积混合时,所得混合溶液的密度为ρ2,两种浓度不同的乙醇(密度小于水)溶液,以相同质量混合时,所得混合溶液的密度为ρ3;以相同体积混合时,所得溶液密度为ρ4,则ρ1、ρ2、ρ3、ρ4大小之间关系为( )
| A. | ρ1>ρ2>ρ3>ρ4 | B. | ρ1>ρ2>ρ4>ρ3 | C. | ρ2>ρ1>ρ3>ρ4 | D. | ρ2>ρ1>ρ4>ρ3 |
5.有如图所示装置,下列有关说法正确的是( )
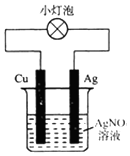

| A. | 该装置外电路中电流由Cu棒转移到Ag棒 | |
| B. | 该装置中正极是Cu、负极是Ag | |
| C. | 该装置可以将电能转化为化学能 | |
| D. | 该装置中正极上的电极反应为Ag++e-=Ag |
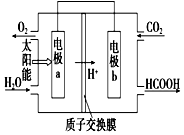 燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.
燃料的使用和防污染是社会发展中一个无法回避的矛盾话题.