题目内容
 (1)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
(1)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.①B中Sn极的电极反应式为:
②C中总电池反应的离子方程式为:
(2)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
①写出FeCl3溶液腐蚀印刷电路铜板的离子方程式
②若将①中的反应设计成原电池,请画出原电池的装置图,并标出正极、负极.原电池装置图为
考点:原电池和电解池的工作原理
专题:
分析:(1)①根据金属活泼性判断原电池的正负极;根据电极反应式得出正确结论;
②根据金属活泼性判断原电池的正负极,得出正确结论;
(2)①氯化铁具有氧化性,能和Cu发生氧化会反应生成氯化亚铁和氯化铜;
②该反应中,铜发生氧化反应作负极、不如铜活泼的金属或导电的非金属作负极,氯化铁溶液作电解质溶液.
②根据金属活泼性判断原电池的正负极,得出正确结论;
(2)①氯化铁具有氧化性,能和Cu发生氧化会反应生成氯化亚铁和氯化铜;
②该反应中,铜发生氧化反应作负极、不如铜活泼的金属或导电的非金属作负极,氯化铁溶液作电解质溶液.
解答:
解:(1)①铁比锡活泼,锡为原电池正极,电极反应式为:2H++2e-=H2↑;氢离子浓度减小,溶液的pH值增大,故答案为:2H++2e-=H2↑;增大;
②锌比铁活泼,锌为原电池负极,被腐蚀,负极电极反应式为Zn-2e-=Zn2+,正极:2H++2e-=H2↑,总反应方程式为Zn+2H+=Zn2++H2↑,
故答案为:Zn+2H+=Zn2++H2↑;
(2)①Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
②设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为 ,故答案为:
,故答案为: .
.
②锌比铁活泼,锌为原电池负极,被腐蚀,负极电极反应式为Zn-2e-=Zn2+,正极:2H++2e-=H2↑,总反应方程式为Zn+2H+=Zn2++H2↑,
故答案为:Zn+2H+=Zn2++H2↑;
(2)①Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
②设计成原电池时,负极上发生氧化反应,正极上发生还原反应,该电池反应中三价铁离子得电子发生还原反应,所以正极上的电极反应式为Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),铜失电子发生氧化反应,所以负极上的电极反应式为Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
电池反应中发生氧化反应的金属作负极,所以铜作负极,不如负极活泼的金属或导电的非金属作正极,可选石墨作正极,发生还原反应的电解质溶液作原电池的电解质溶液,所以该原电池图为
 ,故答案为:
,故答案为: .
.
点评:本题考查了原电池设计,知道哪些反应能设计成原电池,根据反应中元素化合价变化确定正负极、电解质溶液,原电池设计是学习难点,也是考试热点.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
下列叙述中,可以说明金属甲比乙活泼性强的是( )
| A、甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出 |
| B、在氧化还原反应中,甲比乙失去的电子多 |
| C、将甲乙作电极组成原电池时甲做负极 |
| D、将甲乙作电极组成电解池时甲做正极 |
下列叙述中,不正确的是( )
| A、工业上电解饱和食盐水的阳极反应:2Cl--2e-=Cl2↑ |
| B、船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| C、钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH- |
| D、电解池中的阳极和原电池中的负极上都发生还原反应 |
工业上常用焦炭和二氧化硅在电炉中发生氧化还原反应制取粗硅,反应方程式为:2C+SiO2
Si+2CO↑.下列叙述不正确的是( )
| ||
| A、C是还原剂,发生还原反应 |
| B、SiO2是氧化剂,在反应中被还原 |
| C、氧化还原反应的实质是电子的转移 |
| D、氧化还原反应中电子转移的总数与化合价升降总数相等 |
有M、N、P、Z四种金属,请根据以下实验:①M+N2+=M2++N;②用Pt电极电解相同物质的量浓度的P和M的硫酸盐的混合溶液,在阴极上先析出单质M;③把N和Z用导线相连并同时放入Z的硫酸盐溶液中,电极反应为:Z2++2e-=Z,N-2e-=N2+,判断这四种金属的还原性由强到弱的正确顺序是( )
| A、M>N>P>Z |
| B、M>N>Z>P |
| C、Z>P>M>N |
| D、P>M>N>Z |
将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+ 分别加入H2O中,基本上不影响水的电离平衡的是( )
| A、①③⑤⑦⑧ | B、②④⑦ |
| C、①⑥ | D、②④⑥⑧ |
铅蓄电池是常用的直流电源,下列关于如图所示装置的说法中,正确的是( )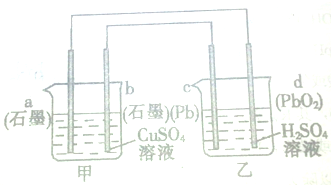

| A、电极b为阳极 |
| B、电极a上发生的反应为Cu2++2e-═Cu |
| C、工作时,装置甲中溶液的pH减小 |
| D、外电路中电子流动方向为由b经导线到c |
 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.