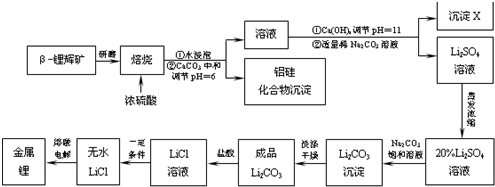
题目内容
15.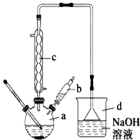 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,
分液得粗溴苯.
| 苯 | 溴 | 溴苯 | |
| 密度/gcm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
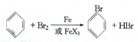
(1)步骤1仪器a中发生的主要反应是
 ;
;(2)仪器c的名称是冷凝管,仪器d的作用是吸收HBr防污染,防倒吸;
(3)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率;
(4)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2(填化学式);
(5)步骤4得到的粗产品中还含有杂质苯,已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
(6)实验结束后,试设计实验方案检验d装置所得溶液中含有Br-:
实验操作:取少量d中溶液于试管中,滴加过量稀HNO3,再加入AgNO3溶液;
实验现象和结论:有淡黄色沉淀生成,溶液中含有Br-.
分析 (1)步骤1仪器a中,苯与液溴发生取代反应制备溴苯;
(2)由图可知仪器c的名称,仪器d为倒扣的漏斗,吸收气体时可防止液体倒吸;
(3)将b中的液溴慢慢加入到a中,防止溴挥发;
(4)仪器c的作用是冷凝回流,使反应物尽可能充分反应;
(5)步骤4得到的粗产品中还含有杂质苯,由苯、溴苯的有关物理性质可知,则要进一步提纯粗产品,利用互溶液体的沸点不同分离;
(6)实验结束后,设计实验方案检验d装置所得溶液中含有Br-,需要硝酸、硝酸银,生成淡黄色沉淀即可.
解答 解:(1)步骤1仪器a中,苯与液溴发生取代反应制备溴苯,反应为 ,
,
故答案为: ;
;
(2)由图可知仪器c的名称为冷凝管,仪器d的作用为吸收HBr防污染,防倒吸,
故答案为:冷凝管;吸收HBr防污染,防倒吸;
(3)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率,
故答案为:防止反应放出的热使C6H6、Br2挥发而影响产率;
(4)仪器c的作用是冷凝回流,使反应物尽可能充分反应,则回流的主要物质有C6H6、Br2,
故答案为:C6H6、Br2;
(5)步骤4得到的粗产品中还含有杂质苯,由苯、溴苯的有关物理性质可知,则要进一步提纯粗产品,利用互溶液体的沸点不同分离,则还进行的实验操作名称是蒸馏,
故答案为:蒸馏;
(6)实验结束后,设计实验方案检验d装置所得溶液中含有Br-,实验操作为取少量d中溶液于试管中,滴加过量稀HNO3,再加入AgNO3溶液,现象和结论为有淡黄色沉淀生成,溶液中含有Br-,
故答案为:取少量d中溶液于试管中,滴加过量稀HNO3,再加入AgNO3溶液;有淡黄色沉淀生成,溶液中含有Br-.
点评 本题考查有机物的制备实验,为高频考点,把握制备实验原理、实验技能、混合物分离提纯、离子检验等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案| A. | 碱式滴定管只用水洗,而未用待测液润洗 | |
| B. | 锥形瓶中残留有蒸馏水 | |
| C. | 酸式滴定管滴定前尖嘴处有气泡,滴定后气泡消失 | |
| D. | 滴定前仰视刻度读数,滴定后俯视刻度读数 |
| A. | 用标准FeCl3溶液滴定KI溶液,选择KSCN溶液 | |
| B. | 用I2溶液滴定Na2SO3溶液,淀粉作指示剂 | |
| C. | 用AgNO3溶液滴定NaCl溶液,Na2CrO4作指示剂 | |
| D. | 用H2O2溶液滴定KI溶液,淀粉作指示剂 |
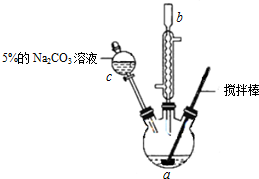
Ⅰ.实验步骤如下:
①向三颈瓶中依次加入:10.0mL丙烯酸(CH2=CHCOOH)、适量的浓硫酸、10.0mL无水甲醇、
2粒沸石,按图示装置连接好冷凝管,用搅拌棒搅拌,水浴加热.
②充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗至中性.
③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70℃~90℃馏分.
可能用到的信息:
| 密度 | 沸点 | 溶解性 | ||
| 丙烯酸 | 1.05g/cm3 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
| 甲醇 | 0.79g/cm3 | 64.7℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
| 丙烯酸甲酯 | 0.95g/cm3 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
(1)仪器c的名称是分液漏斗.
(2)混合液用5% Na2CO3溶液洗涤的作用是除去丙烯酸、浓硫酸等酸性物质.
(3)该实验中应采用的安全防护措施有通风橱中实验.(1条即可)
Ⅱ.为测定上述反应中丙烯酸甲酯的产率,设计如下实验:
①将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol/L的KOH溶液10.0mL,加热使之完全水解.
②用酚酞做指示剂,向冷却后的溶液中滴加0.5mol/L的HCl溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00mL.
(4)请写出(Ⅱ)操作①中发生的化学反应方程式CH2=CHCOOCH3+KOH$\stackrel{△}{→}$CH2=CHCOOK+CH3OH.
(5)计算本次酯化反应丙烯酸甲酯的产率.
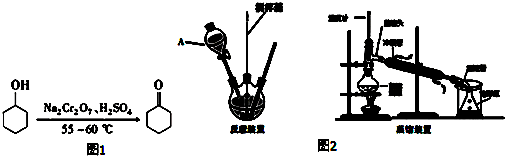
反应原理:如图1所示
反应放热,温度过高或者重铬酸钠过量会进一步氧化.
主要物料及产物的物理参数:
| 名称 | 性状 | 密度 | 溶点℃ | 沸点℃ | 溶解度 | |
| 水 | 乙醚 | |||||
| 环已醇 | 无色,有刺激性气味 | 0.9624 | 25.93 | 161.5 | 5.67g/100mL | ∞ |
| 环已酮 | 无色,有刺激性气味 | 0.9478 | - | 155.7 | 2.4g/100mL | ∞ |
如图2所示
实验步骤:
Ⅰ.投料:在100mL三颈烧瓶中加入20mL水,慢慢加入5mL浓硫酸摇动,振荡下缓慢加入5mL(4.8g,0.048mol)环己醇,并将混合液温度降至30℃以下.将5g(0.019mol)重铬酸钠溶于水得橙红色溶液备用.
Ⅱ.反应:将约$\frac{1}{5}$的重铬酸钠溶液加入三颈烧瓶中,充分搅拌使之混合均匀.冷水浴冷却,控制反应温度在55~60℃.待橙红色消失后,再将剩余的重铬酸钠溶液分四次加入到三颈烧瓶中.当温度自动下降时,加入4mL甲醇使反应液完全变成墨绿色(三价铬);
Ⅲ.蒸馏:在反应瓶中加入30mL水,并改为蒸馏装置,收集90~99℃之间的馏分(环己酮与水的共沸物)至无油珠为止;
Ⅳ.萃取、干燥:将馏出液用食盐饱和后转入分液漏斗中,分出有机层.水层用8mL乙醚提取一次,将乙醚提取液和有机层合并,用无水硫酸镁干燥; 5.蒸馏,收集环己酮产品2.6g. 请回答下列问题:
(1)装置A的名称是分液漏斗.
(2)完成并配平反应方程式:
3
 +1 Na2Cr2O7+4H2SO4→3
+1 Na2Cr2O7+4H2SO4→3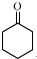 +1 Na2SO4+1 Cr2(SO4)3+7 H2O
+1 Na2SO4+1 Cr2(SO4)3+7 H2O(3)反应过程中加入甲醇后有无色气体生成.加入甲醇的作用是将过量的重铬酸钠还原,防止环己酮继续被氧化,请用离子方程式表示反应原理CH3OH+Cr2O72-+8H+→CO2↑+2Cr3++6H2O.
(4)步骤4向馏出液加入食盐的目的是利用盐析原理,减少环己酮在水中的溶解度,有利于分层,将乙醚提取液和有机层合并的原因是减少环己酮在水中溶解造成的损失.
(5)计算所得产品的产率55.3%.(保留三位有效数字)
| A. | 汽油失火时,立即用水灭火 | |
| B. | 实验室不小心碰翻酒精灯引起实验桌上洒落的少量酒精起火时,迅速用泡沫灭火器灭火 | |
| C. | 浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤 | |
| D. | 浓 NaOH 溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 |