题目内容
18.元素A原子的L电子层比元素B原子的L电子层少3个电子,B元素原子核外电子总数比A元素原子核外电子总数多5个,则A、B形成的化合物的化学式可能为( )| A. | B2A3 | B. | B3A2 | C. | A2B3 | D. | BA2 |
分析 A元素原子的L层比B元素原子的L层少3个电子,则A有2个电子层,B元素的原子核外电子总数比A元素原子的核外电子总数多5个,则B原子不能处于第二周期,可推知A的L层电子数为8-3=5,则A为N元素,则B的原子核外电子数为12,B为Mg元素,以此解答该题.
解答 解:A元素原子的L层比B元素原子的L层少3个电子,则A有2个电子层,B元素的原子核外电子总数比A元素原子的核外电子总数多5个,则B原子不能处于第二周期,可推知A的L层电子数为5,则A为N元素,则B的原子核外电子数为12,B为Mg元素,则A与B可形成的化合物为Mg3N2,符合B3A2型,
故选B.
点评 本题考查原子结构与元素的性质,为高频考点,把握A为第二周期元素N为解答的关键,侧重分析与推断能力的考查,注意L层最多排8个电子,题目难度不大.

练习册系列答案
相关题目
16.短周期元素X、Y、W、Q在元素周期表中位置如图所示.下列说法正确的是( )
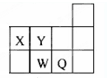

| A. | 元素X与元素Y可形成多种化合物 | |
| B. | 原子半径的大小顺序为:X>Y>W>Q | |
| C. | 还原性:W2-<Q- | |
| D. | 元素W的最高价氧化物对应水化物的酸性比Q的强 |
17.白藜芦醇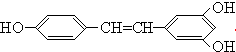 广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性,下列关于白藜芦醇的说法错误的是( )
广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性,下列关于白藜芦醇的说法错误的是( )
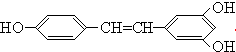 广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性,下列关于白藜芦醇的说法错误的是( )
广泛存在于食物(例如桑葚、花生,尤其是葡萄)中,它可能具有抗癌性,下列关于白藜芦醇的说法错误的是( )| A. | 白藜芦醇属于三元醇,能与Na反应产生H2 | |
| B. | 能与NaOH反应,1mol该化合物最多能消耗NaOH 3mol | |
| C. | 能使FeCl3溶液显色 | |
| D. | 能与浓溴水反应,1mol该化合物最多能消耗溴6mol |
6.下列说法正确的是( )
| A. | 只含离子键的化合物称为离子化合物 | |
| B. | 化学键不仅存在于原子间,也存在于分子间 | |
| C. | 原子间通过极性键结合成分子的物质,一定是共价化合物 | |
| D. | 不同元素组成的多原子分子里的化学键一定是极性键 |
13.二甲醚(CH3OCH3)是一种新型能源,利用二氧化碳合成新能源已成为环保化学家研究的热门课题.
(1)几种共价键的键能如表所示:
2CO2(g)+6H2(g)═CH3OCH3(g)+3H2O(g)△H=-92KJ•mol-1.
(2)“人工光合作用”技术备受瞩目,该技术模拟事物的光合作用,利用太阳光将H2O和CO2直接合成燃料和化工原料.科研人员模拟光合作用,设计如图甲所示装置制备二甲醚.能量转化形式为太阳能→电能→化学能、
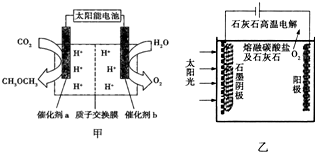
①催化剂b的电极名称是阳极.
②若释放11.2L氧气(标准状况下),有2mol H+由b移向a(填质子的迁移方向).催化剂a上的电极反应式为2CO2+12H++12e-=CH3OCH3+3H2O.
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2的零排放,其基本原理如图乙所示:
①生产过程中能量的转化形式是太阳能和电能转化为化学能.
②电解反应在温度小于900℃时进行,盐酸钙分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑,阴极的电极反应式为3CO2+4e-=C+2CO32-.
(1)几种共价键的键能如表所示:
| 化学键 | C═O | H-H | C-H | C-O | H-O |
| 键能/kJ•mol-1 | 803 | 436 | 414 | 326 | 464 |
(2)“人工光合作用”技术备受瞩目,该技术模拟事物的光合作用,利用太阳光将H2O和CO2直接合成燃料和化工原料.科研人员模拟光合作用,设计如图甲所示装置制备二甲醚.能量转化形式为太阳能→电能→化学能、

①催化剂b的电极名称是阳极.
②若释放11.2L氧气(标准状况下),有2mol H+由b移向a(填质子的迁移方向).催化剂a上的电极反应式为2CO2+12H++12e-=CH3OCH3+3H2O.
(3)华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2的零排放,其基本原理如图乙所示:
①生产过程中能量的转化形式是太阳能和电能转化为化学能.
②电解反应在温度小于900℃时进行,盐酸钙分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑,阴极的电极反应式为3CO2+4e-=C+2CO32-.
8.已知14.2g X气体在标准状况下的体积是4.48L,则X气体的摩尔质量是( )
| A. | 71 | B. | 142 | C. | 71 g/mol | D. | 142 g/mol |