题目内容
4.下列关于25℃的NaHCO3溶液的相关事实,能够证明H2CO3为弱酸的是( )| A. | 溶液中存在CO32- | B. | 溶液中c(H+)•c(OH-)=10-14 | ||
| C. | 与等物质的量的NaOH恰好中和 | D. | 溶液中c(Na+)>c(CO32-) |
分析 弱酸属于弱电解质,在溶液中部分电离,存在电离平衡,据此分析.
解答 解:A.溶液中存在CO32-,说明NaHCO3发生电离,但不一定是部分电离,所以不能证明H2CO3为弱酸,故A错误;
B.25℃的溶液中均存在c(H+)•c(OH-)=10-14,与H2CO3的酸性强弱无关,故B错误;
C.与等物质的量的NaOH恰好中和,说明NaHCO3能电离出氢离子,但不一定是部分电离,所以不能证明H2CO3为弱酸,故C错误;
D.溶液中c(Na+)>c(CO32-),说明HCO3-的电离为部分电离,所以能够证明H2CO3为弱酸,故D正确.
故选D.
点评 本题考查了弱电解质的电离,题目难度不大,注意把握弱电解质在溶液中部分电离的特点,侧重于考查学生的分析能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列有关实验装置进行的相应实验,能达到实验目的是( )
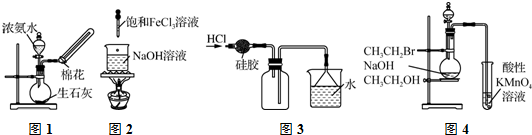

| A. | 利用图1所示装置制取少量NH3 | |
| B. | 利用图2所示装置制备Fe(OH)3胶体 | |
| C. | 利用图3所示装置收集HCl | |
| D. | 利用图4所示装置检验是否生成乙烯 |
8.下列物质中,熵值(s)最大的是( )
| A. | 金刚石 | B. | Cl2(l) | C. | I2(g) | D. | Cu(s) |
12.已知室温时,0.1mol?L-1 某一元酸 HA 在水中有 0.1%发生电离,下列叙述错误的是( )
| A. | 该溶液的 pH=4 | |
| B. | 升高温度,溶液的 pH 增大 | |
| C. | 此酸的电离平衡常数约为 1×10-7 | |
| D. | 由 HA 电离出的 c(H+)约为水电离出的 c(H+)的106倍 |
19.在已达到电离平衡的0.1mol/L的醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的pH降低,应采取的措施是( )
| A. | 加少量盐酸 | B. | 加热 | ||
| C. | 加少量醋酸钠晶体 | D. | 加少量NaOH晶体 |
13.不慎误服BaCl2后,可服用的解毒剂是( )
| A. | NaCl | B. | Na2CO3 | C. | AgNO3 | D. | MgSO4 |

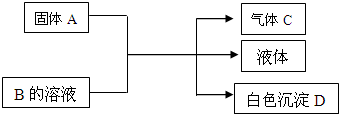 A、B、C、D均为中学化学常见的物质,它们间的反应关系如图所示.
A、B、C、D均为中学化学常见的物质,它们间的反应关系如图所示.