题目内容
9.在恒温恒容的容器中进行反应2A(g)?B(g),若反应物的浓度由0.1mol/L降到0.06mol/L需要20s,那么再由0.06mol/L降到0.034mol/L所需反应时间应( )| A. | 等于10s | B. | 等于12s | C. | 小于12s | D. | 大于13s |
分析 恒温恒容条件下,根据v=$\frac{△c}{△t}$计算反应速率,但反应物浓度越小反应速率越小,根据△t=$\frac{△c}{v}$计算反应时间.
解答 解:恒温恒容条件下,前20s平均反应速率v=$\frac{△c}{△t}$=$\frac{(0.1-0.06)}{20}$mol/(L.s)=0.002mol/(L.s),如果反应速率仍然是0.002mol/(L.s),则反应所需时间△t=$\frac{△c}{v}$=$\frac{0.06-0.034}{0.002}$s=13s,但反应物浓度越小反应速率越小,所以所需时间大于13s,故选D.
点评 本题考查化学反应速率的有关计算,为高频考点,明确反应速率与反应物浓度关系是解本题关键,反应物浓度越大反应速率越大,题目难度不大.

练习册系列答案
相关题目
17.亚硝酸钠(NaNO2)是重要的防腐剂.某化学兴趣小组尝试制备亚硝酸钠,查阅资料:①HNO2为弱酸,在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成.
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
探究一 亚硝酸钠固体的制备
以碳和浓硝酸为起始原料,设计如图1装置利用一氧化氮与过氧化钠反应制备亚硝酸钠.(反应方程式为2NO+Na2O2═2NaNO2,部分夹持装置和A中加热装置已略)

(1)写出装置A烧瓶中发生反应的化学方程式C+4HNO3(浓)$\frac{\underline{\;加热\;}}{\;}$CO2↑+4NO2↑+2H2O.
(2)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂应是B(填字母).
A.浓H2SO4 B.碱石灰 C.无水CaCl2
探究二 亚硝酸钠固体含量的测定及性质验证
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
(3)第一组实验数据出现异常,造成这种异常的原因可能是A、C(填字母).
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(4)根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%.
(5)亚硝酸钠易溶于水,将0.2mol•L-1的亚硝酸钠溶液和0.1mol•L-1的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为c(Na+)>c(NO2-)>c(Cl-)>c(H+)>c(OH-).
探究三 反应废液的处理
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理.25℃时,反应进行10min,溶液的pH由7变为12.电化学降解NO3-的原理如图2所示.
(6)电源正极为A(填A或B),阴极反应式为2NO3-+6H2O+10e-=N2↑+12OH-.
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
探究一 亚硝酸钠固体的制备
以碳和浓硝酸为起始原料,设计如图1装置利用一氧化氮与过氧化钠反应制备亚硝酸钠.(反应方程式为2NO+Na2O2═2NaNO2,部分夹持装置和A中加热装置已略)

(1)写出装置A烧瓶中发生反应的化学方程式C+4HNO3(浓)$\frac{\underline{\;加热\;}}{\;}$CO2↑+4NO2↑+2H2O.
(2)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂应是B(填字母).
A.浓H2SO4 B.碱石灰 C.无水CaCl2
探究二 亚硝酸钠固体含量的测定及性质验证
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(4)根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%.
(5)亚硝酸钠易溶于水,将0.2mol•L-1的亚硝酸钠溶液和0.1mol•L-1的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为c(Na+)>c(NO2-)>c(Cl-)>c(H+)>c(OH-).
探究三 反应废液的处理
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理.25℃时,反应进行10min,溶液的pH由7变为12.电化学降解NO3-的原理如图2所示.
(6)电源正极为A(填A或B),阴极反应式为2NO3-+6H2O+10e-=N2↑+12OH-.
4.能正确表示下列反应的离子方程式是( )
| A. | 硫氢化钠的水解反应 HS-+H2O?S2-+H3O+ | |
| B. | 碳酸氢钙与过量的 NaOH 溶液反应 Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | Na2O2与H2O反应制备O2 Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | 向碳酸钠溶液中加少量盐酸 CO32-+2H+═H2O+CO2↑ |
1.给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
| A. | 粗硅$→_{高温}^{Cl_{2}}$SiCl4 $→_{高温}^{H_{2}}$Si | |
| B. | Mg(OH)2 $\stackrel{盐酸}{→}$NgCl2(ag) $\stackrel{电解}{→}$Mg | |
| C. | Fe2O3 $\stackrel{盐酸}{→}$FeCl3(ag) $\stackrel{蒸发}{→}$无水FeCl3 | |
| D. | Cu $\stackrel{稀硝酸}{→}$NO2 $\stackrel{水}{→}$NO |
18.下列说法正确的是( )
| A. | 在标准状况下,1mol水和1molH2的 体积都约是22.4L | |
| B. | 2gH2和44gCO2的体积相等 | |
| C. | 1mol某气体的体积为22.4L,则该气 体一定处于标准状况 | |
| D. | 在标准状况下,1molH2和O2的混合气体体积约是22.4L |
19.下列离子方程式相对应的化学方程式正确的是( )
| A. | Zn2++2OH-═Zn(OH)2↓;ZnCO3+2NaOH═Zn(OH)3↓+Na2CO3 | |
| B. | Ba2++SO42-═BaSO4↓;Ba(OH)2+H2SO4═BaSO4↓+2H2O | |
| C. | Ag++Cl-═AgCl↓;AgNO3+NaCl═AgCl↓+NaNO3 | |
| D. | Cu+2Ag+═Cu2++2Ag↓;Cu+2AgCl═2Ag+CuCl2 |
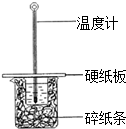 某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定
某学生实验小组用50mL0.50mol•L-1的盐酸与50mL0.50mol•L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定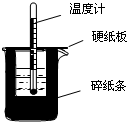 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: