题目内容
某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3等,回收镁和其中另一种金属单质的工艺流程如图1:部分阳离子以氢氧化物形式完全沉淀时溶液的pH如表,请回答下列问题:
(1)写出碱漫时反应的离子方程式 .
(2)可回收到的金属A的原子结构示意图为
(3)“浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出两条措施).
(4)调pH时需要调多次,第一次调pH主要为了除去
(5)MgCl2?6H2O在HC1氛围中灼烧后可通过 (写出化学反应方程式)得到单质Mg.
(6)Mg(ClO3)2在农业上有广泛的用途,可用NaClO3与MgCl2制备,已知四种化合物的溶解度(S)随温度(T)变化曲线如图2所示.
①写出反应的化学反应方程式:
②将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2简述可制备Mg(ClO3)2的原因
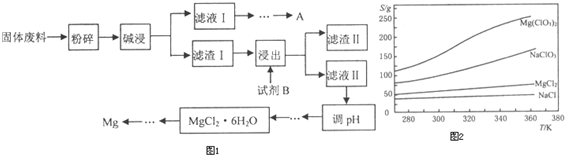
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| pH | 3.2 | 5.2 | 12.4 |
(2)可回收到的金属A的原子结构示意图为
(3)“浸出”步骤中,为提高镁的浸出率,可采取的措施有
(4)调pH时需要调多次,第一次调pH主要为了除去
(5)MgCl2?6H2O在HC1氛围中灼烧后可通过
(6)Mg(ClO3)2在农业上有广泛的用途,可用NaClO3与MgCl2制备,已知四种化合物的溶解度(S)随温度(T)变化曲线如图2所示.
①写出反应的化学反应方程式:
②将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2简述可制备Mg(ClO3)2的原因

考点:金属的回收与环境、资源保护,难溶电解质的溶解平衡及沉淀转化的本质
专题:实验题,电离平衡与溶液的pH专题
分析:(1)MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3这些物质中只有氧化铝具有两性,能与氢氧化钠反应;(2)依据(1)分析可知,碱浸后的滤液中含有的金属是Al,Al有3个电子层,最外层电子数为3;
(3)浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来分析判断;
(4)依据部分阳离子以氢氧化物形式完全沉淀时溶液的pH表格得知,最先升高pH值到3.2-5.2之间沉淀析出的是氢氧化铁;
(5)电解熔融氯化镁可以生成镁单质,化学反应方程式为:,故答案为:MgCl2
Mg+Cl2↑;
(6)①依据元素守恒以及氧化还原反应原理书写即可;
②根据侯德榜制碱法生成NaHCO3的原理.
(3)浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来分析判断;
(4)依据部分阳离子以氢氧化物形式完全沉淀时溶液的pH表格得知,最先升高pH值到3.2-5.2之间沉淀析出的是氢氧化铁;
(5)电解熔融氯化镁可以生成镁单质,化学反应方程式为:,故答案为:MgCl2
| ||
(6)①依据元素守恒以及氧化还原反应原理书写即可;
②根据侯德榜制碱法生成NaHCO3的原理.
解答:
解:(1)氧化铝能溶于氢氧化钠,生成偏铝酸钠和水,离子反应方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(2)碱浸后的滤液中含有的金属是Al,Al有3个电子层,最外层电子数为3,Al的原子结构示意图为: ,故答案为:
,故答案为: ;
;
(3)浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可以通过增大接触面积提高反应速率,提高镁的浸出率,可通过升高温度提高硫酸镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率;故答案为:研磨固体废料;增大硫酸浓度;加热升高温度、边加硫酸边搅研拌;
(4)依据部分阳离子以氢氧化物形式完全沉淀时溶液的pH表格得知,最先升高pH值到3.2-5.2之间沉淀析出的是氢氧化铁,故答案为:Fe3+;
(5)电解熔融氯化镁可以生成镁单质,化学反应方程式为:MgCl2
Mg+Cl2↑,故答案为:MgCl2
Mg+Cl2↑;
(6)①依据题意得出反应物为:NaClO3和MgCl2,生成物为:Mg(ClO3)2,故化学反应方程式为:2NaClO3+MgCl2=Mg(ClO3)2+2NaCl↓,
故答案为:2NaClO3+MgCl2=Mg(ClO3)2+2NaCl↓;
②在相同温度下,由于NaCl溶解度较小最先析出,在降温的过程中,Mg(ClO3)2的溶解度也不断减小,从溶液中析出,通过蒸发结晶即可获取,
故答案为:在相同温度下,由于NaCl溶解度较小最先析出,Mg(ClO3)2剩余在溶液中通过蒸发结晶可得.
(2)碱浸后的滤液中含有的金属是Al,Al有3个电子层,最外层电子数为3,Al的原子结构示意图为:
 ,故答案为:
,故答案为: ;
;(3)浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可以通过增大接触面积提高反应速率,提高镁的浸出率,可通过升高温度提高硫酸镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率;故答案为:研磨固体废料;增大硫酸浓度;加热升高温度、边加硫酸边搅研拌;
(4)依据部分阳离子以氢氧化物形式完全沉淀时溶液的pH表格得知,最先升高pH值到3.2-5.2之间沉淀析出的是氢氧化铁,故答案为:Fe3+;
(5)电解熔融氯化镁可以生成镁单质,化学反应方程式为:MgCl2
| ||
| ||
(6)①依据题意得出反应物为:NaClO3和MgCl2,生成物为:Mg(ClO3)2,故化学反应方程式为:2NaClO3+MgCl2=Mg(ClO3)2+2NaCl↓,
故答案为:2NaClO3+MgCl2=Mg(ClO3)2+2NaCl↓;
②在相同温度下,由于NaCl溶解度较小最先析出,在降温的过程中,Mg(ClO3)2的溶解度也不断减小,从溶液中析出,通过蒸发结晶即可获取,
故答案为:在相同温度下,由于NaCl溶解度较小最先析出,Mg(ClO3)2剩余在溶液中通过蒸发结晶可得.
点评:本题考查对常见金属元素及其化合物主要性质的掌握,以及对离子反应实质的认识;同时考查应用基础知识解决简单化学问题的能力以及对图表的观察、分析能力,物质溶解度概念的应用,晶体析出的方法,杂质离子的除杂原则和试剂选择,题目难度较大.

练习册系列答案
相关题目
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入70mL 4.0mol/L盐酸中,充分反应后产生448mL H2(标准状况),残留固体0.64g.过滤,滤液中无Cu2+.将滤液加水稀释到200mL,测得其中c(H+)为0.20mol/L.则原混合物中单质铁的质量是( )
| A、4.48g |
| B、3.36g |
| C、3.25g |
| D、2.80g |
有机物 的名称是( )
的名称是( )
 的名称是( )
的名称是( )| A、2,3,3一三甲基丁烷 |
| B、3,2,2一三甲基丁烷 |
| C、2,2,3-三甲基丁烷 |
| D、3,3,2一三甲基丁烷 |
0.5mol某烃与1molHCl在一定条件下恰好完全加成,生成物再在光照下与Cl2发生取代反应,氢原子恰好全部被取代消耗Cl23mol,则该烃的分子式为( )
| A、C3H6 |
| B、C4H6 |
| C、C3H4 |
| D、C2H4 |
已知X2、Y2、Z2、W2四种物质的氧化能力为W2>Z2>X2>Y2,下列氧化还原反应能发生的是( )
| A、2NaW+Z2═2NaZ+W2 |
| B、2NaX+Z2═2NaZ+X2 |
| C、2NaW+Y2═2NaY+W2 |
| D、2NaZ+X2═2NaX+Z2 |
对于常温下pH=11的氨水溶液,下列说法中正确的是( )
| A、加水稀释100倍,9<pH<11 |
| B、加入少量NH4Cl固体,溶液的pH升高 |
| C、加水稀释后c(OH-)/c(NH3?H2O)值将减小 |
| D、完全中和等浓度等体积的盐酸,耗氨水的体积比pH=11的NaOH溶液大 |