题目内容
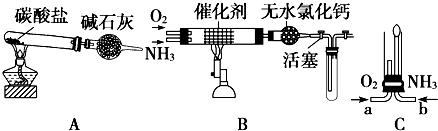
资料显示:“氨气可在纯氧中安静燃烧…”.某校化学小组学生设计如图装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验.
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是 ;碱石灰的作用是 .
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:氨催化氧化的化学方程式是 ;试管内气体变为红棕色,该反应的化学方程式是 .
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:两气体通入的先后顺序是 ,其理由是 .
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:氨催化氧化的化学方程式是
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:两气体通入的先后顺序是

考点:氨的制取和性质
专题:
分析:(1)碳酸铵或者碳酸氢铵不稳定受热易分解生成氨气;氨气为碱性气体,应选择碱性干燥剂;
(2)氨气催化氧化生成一氧化氮和水,一氧化氮不稳定遇到氧气反应生成红棕色的二氧化氮气体;
(3)若先通入NH3,NH3在空气中不能点燃,可在纯氧中安静燃烧,依次进行判断.
(2)氨气催化氧化生成一氧化氮和水,一氧化氮不稳定遇到氧气反应生成红棕色的二氧化氮气体;
(3)若先通入NH3,NH3在空气中不能点燃,可在纯氧中安静燃烧,依次进行判断.
解答:
解:(1)碳酸铵或者碳酸氢铵不稳定受热易分解生成氨气,所以大试管内碳酸盐的化学式是(NH4)2CO3或NH4HCO3;
氨气为碱性气体,应选择碱性干燥剂,碱石灰为碱性干燥剂,能够吸收氨气中的水和二氧化碳;
故答案为:(NH4)2CO3或NH4HCO3 吸收水和二氧化碳;
(2)氨气催化氧化生成一氧化氮和水,方程式为:4NH3+5O2
4NO+6H2O;
一氧化氮不稳定遇到氧气反应生成红棕色的二氧化氮气体,方程式为:2NO+O2═2NO2;
故答案为:4NH3+5O2
4NO+6H2O;2NO+O2═2NO2;
(3)由于装置C上端开口,要点燃NH3,须先通入O2,后通入NH3,因为若先通入NH3,NH3在空气中不能点燃,NH3逸出会造成污染;
故答案为:先通入O2,后通入NH3,若先通氨气,氨在空气中不能点燃,逸出造成大气污染.
氨气为碱性气体,应选择碱性干燥剂,碱石灰为碱性干燥剂,能够吸收氨气中的水和二氧化碳;
故答案为:(NH4)2CO3或NH4HCO3 吸收水和二氧化碳;
(2)氨气催化氧化生成一氧化氮和水,方程式为:4NH3+5O2
| ||
| △ |
一氧化氮不稳定遇到氧气反应生成红棕色的二氧化氮气体,方程式为:2NO+O2═2NO2;
故答案为:4NH3+5O2
| ||
| △ |
(3)由于装置C上端开口,要点燃NH3,须先通入O2,后通入NH3,因为若先通入NH3,NH3在空气中不能点燃,NH3逸出会造成污染;
故答案为:先通入O2,后通入NH3,若先通氨气,氨在空气中不能点燃,逸出造成大气污染.
点评:本题考查了氨气的制备及性质检验,熟悉氨气制备原理及氨气的化学性质是解题关键,题目难度不大.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
分子式为C10H14,属于苯的同系物,且苯环上的一氯代物只有2种的有机物有(不考虑立体异构,苯环上至少有3个氢)( )
| A、5种 | B、6种 | C、7种 | D、8种 |
下列关于铝的叙述中,不正确的是( )
| A、铝是地壳里含量最多的金属元素 |
| B、铝容易失去电子,表现还原性 |
| C、在空气中用酒精灯点不着 |
| D、在常温下,铝不能与氧气反应 |
 甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A、金属性:甲>乙>丁 |
| B、原子半径:辛>戊>甲 |
| C、丙与庚的元素原子核外电子数相差13 |
| D、形成的最简单氢化物的稳定性:己>戊 |
 已知:A、B、C、D、E、F六种元素,原子序数依次增大.A原子核外有两种形状的电子云,两种形状的电子云轨道上的电子数相等;B是短周期中原子半径最大的元素;C元素的原子3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素.试回答下列有关的问题:
已知:A、B、C、D、E、F六种元素,原子序数依次增大.A原子核外有两种形状的电子云,两种形状的电子云轨道上的电子数相等;B是短周期中原子半径最大的元素;C元素的原子3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素.试回答下列有关的问题: