题目内容
有如下反应:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,其中氧化剂是 氧化产物是 ,氧化剂与还原剂的物质的量之比为 ,硝酸表现的性质为 .
考点:氧化还原反应
专题:氧化还原反应专题
分析:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O中,Fe元素的化合价升高,N元素的化合价降低,以此来解答.
解答:
解:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O中,Fe元素的化合价升高,Fe为还原剂,失去电子被氧化,则氧化产物为Fe(NO3)2,N元素的化合价降低,HNO3为氧化剂,由反应可知8molHNO3反应只有2mol作氧化剂,硝酸在反应中起酸性和氧化性作用,氧化剂与还原剂的物质的量之比为2:3,
故答案为:HNO3;Fe(NO3)2;2:3;氧化性和酸性.
故答案为:HNO3;Fe(NO3)2;2:3;氧化性和酸性.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
同体积、同物质的量浓度的KCl、CaCl2、AlCl3三种溶液中Cl-的物质的量浓度之比是( )
| A、3:2:1 |
| B、1:2:3 |
| C、1:1:1 |
| D、2:3:1 |
下列反应中,属于加成反应的是( )
| A、CH2=CH2+HCl→CH3CH2Cl | |||
B、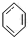 +HO-NO2 +HO-NO2
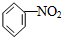 +H2O +H2O | |||
C、CH4+Cl2
| |||
D、2 CH3CH2OH+O2
|
下列关于化学基本概念和基本理论的认识中正确的是( )
| A、用红外光谱分析仪可以确定物质中是否存在C、H、O、N、S、Cl等元素 |
| B、根据化合物中含氢数目的多少,把化合物分为一元酸、二元酸、三元酸等 |
| C、碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 |
| D、一定温度、压强下,一定数量的任何物质的体积由微粒间的平均距离所决定 |
向11.2g Fe2O3、Cu的混合物中加入0.25mol?L-1的硫酸溶液600mL时,固体恰好完全溶解,溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( )
| A、2.4g | B、1.6g |
| C、4.8g | D、6.4g |
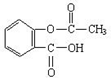 化学是造福人类的科学,在人体保健、医疗卫生等方面作出了重大的贡献.请你用所学的化学知识解答有关问题.
化学是造福人类的科学,在人体保健、医疗卫生等方面作出了重大的贡献.请你用所学的化学知识解答有关问题.