题目内容
3.某温度下,反应2N2O5(g)═4NO2(g)+O2(g)开始时,c(N2O5)=0.040 8mol•L-1,经1min后,c(N2O5)=0.030 0mol•L-1.则该反应的反应速率为( )| A. | v(N2O5)=1.80×10-3 mol•L-1•min-1 | B. | v(N2O5)=1.08×10-2 mol•L-1•min-1 | ||
| C. | v(NO2)=1.80×10-3 mol•L-1•min-1 | D. | v(O2)=1.80×10-2 mol•L-1•min-1 |
分析 根据v=$\frac{△c}{△t}$、化学反应速率之比等化学计量数之比进行计算
解答 解:v(N2O5)=$\frac{0.0408mol/L-0.030mol/L}{1min}$=1.08×10-2mol•L-1•min-1,化学反应速率之比等于化学方程式计量数之比,
v(N2O5):v(NO2)=1:2,故v(NO2)=2v(N2O5)=2×1.08×10-2mol=3.16×10-2mol•L-1•s-1;
v(N2O5):v(O2)=2:1,故v(O2)=0.5v(N2O5)=0.5×1.08×10-2mol=5.4×10-3mol•L-1•s-1;
故选B.
点评 本题考查化学反应速率的相关计算,把握化学反应速率的定义和化学反应速率之比等化学计量数之比为解答的关键,题目难度不大.

练习册系列答案
相关题目
11.某有机物甲在稀硫酸中加热水解生成乙和丙,乙在一定条件下可以转化成丙,下列有关甲的分子式与符合该条件的同分异构体数目的判断中不正确的是( )
| 选项 | 分子式 | 同分异构体数目 |
| A | C4H8O2 | 1 |
| B | C6H12O2 | 2 |
| C | C8H16O2 | 3 |
| D | C10H20O2 | 4 |
| A. | A | B. | B | C. | C | D. | D |
18.下列叙述正确的是( )
| A. | 天然植物油常温下一般呈液态,难溶于水,没有恒定的熔、沸点 | |
| B. | 棉花、蚕丝的主要成分都是纤维素 | |
| C. | 常温常压下,0.1 mol D${\;}_{2}^{18}$O中含有的中子数、质子数、电子数均为NA | |
| D. | 乙烯和苯都能使溴水中的水层褪色,褪色的原因相同 |
8.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是( )


| A. | ①②④ | B. | ①②③ | C. | ①② | D. | ②③④ |
15.短周期元素W、X、Y、Z在元素周期表中的位置所示.其中Z的单质是一种重要半导体材料,广泛应用于电子工业的各个领域.
(1)W在元素周期表中的位置是第二周期第ⅣA族.
(2)W、X、氢元素形成的三原子分子的电子式 .
.
(3)下列选项中,能证明元素非金属性X强于W的是CD.
A.原子序数:X>W B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如图所示的转化:
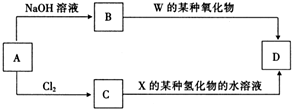
其中化合物D是一种白色沉淀,则B中溶质的化学式为NaAlO2;B与C也可直接转化生成D写出对应的离子方程式为Al3++3AlO2-+6H2O=Al(OH)3↓.
| W | X | ||
| Y | Z |
(2)W、X、氢元素形成的三原子分子的电子式
 .
.(3)下列选项中,能证明元素非金属性X强于W的是CD.
A.原子序数:X>W B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如图所示的转化:

其中化合物D是一种白色沉淀,则B中溶质的化学式为NaAlO2;B与C也可直接转化生成D写出对应的离子方程式为Al3++3AlO2-+6H2O=Al(OH)3↓.
13.下列反应不属于四个基本反应类型,但属于氧化还原反应的是( )
| A. | Fe+CuSO4=FeSO4+Cu | B. | Cl2+H2O=HCl+HClO | ||
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | D. | AgNO3+HCl=AgCl↓+HNO3 |
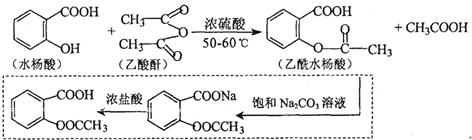
 .
. .
.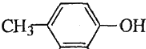 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件: .
.