��Ŀ����
��֪����Cl2ͨ������KOH��Һ�У������п�����KCl��KClO��KClO3����
��ֵ���¶ȸߵ��йأ���n��KOH��=a molʱ�������й�˵��������ǣ�������
| c(Cl-) |
| c(ClO-) |
A����ij�¶��£���Ӧ��
| ||||||
B���μӷ�Ӧ�����������ʵ�������
| ||||||
C���ı��¶ȣ���Ӧ��ת�Ƶ��ӵ����ʵ���ne�ķ�Χ��
| ||||||
D���ı��¶ȣ�������KClO3��������۲���Ϊ
|
���㣺���⼯��,�����Ļ�ѧ����
ר�⣺±��Ԫ��
������A����n��ClO-��=1mol����Ӧ��
=11����n��Cl-��=11mol�����ݵ���ת���غ����n��ClO3-�����ݴ˼����жϣ�
B����Clԭ���غ��֪��2n��Cl2��=n��KCl��+n��KClO��+n��KClO3�����ɼ������غ��֪n��KCl��+n��KClO��+n��KClO3��=n��KOH����
C����������ֻ��KClO3ʱ��ת�Ƶ�����࣬��������ֻ��KClOʱ��ת�Ƶ������٣����ݵ���ת���غ㼰�������غ���㣻
D����������ֻ��KClO3ʱ�������ʵ�������C�м����жϣ�
| c(Cl-) |
| c(ClO-) |
B����Clԭ���غ��֪��2n��Cl2��=n��KCl��+n��KClO��+n��KClO3�����ɼ������غ��֪n��KCl��+n��KClO��+n��KClO3��=n��KOH����
C����������ֻ��KClO3ʱ��ת�Ƶ�����࣬��������ֻ��KClOʱ��ת�Ƶ������٣����ݵ���ת���غ㼰�������غ���㣻
D����������ֻ��KClO3ʱ�������ʵ�������C�м����жϣ�
���
�⣺A����n��ClO-��=1mol����Ӧ��
=11����n��Cl-��=11mol������ת���غ㣬5��n��ClO3-��+1��n��ClO-��=1��n��Cl-������5��n��ClO3-��+1��1mol=1��11mol�����n��ClO3-��=2mol������Һ��
=
����A��ȷ��
B����Clԭ���غ��֪��2n��Cl2��=n��KCl��+n��KClO��+n��KClO3�����ɼ������غ��֪n��KCl��+n��KClO��+n��KClO3��=n��KOH�����ʲμӷ�Ӧ�����������ʵ���=
n��KOH��=
a mol����B��ȷ��
C����������ֻ��KClO3ʱ��ת�Ƶ�����࣬���ݵ���ת���غ�n��KCl��=5��KClO3�����ɼ������غ㣺n��KCl��+n��KClO3��=n��KOH������n��KClO3��=
n��KOH��=
a mol��ת�Ƶ���������ʵ���=
a mol��5=
a mol����������ֻ��KClOʱ��ת�Ƶ������٣����ݵ���ת���غ�n��KCl��=n��KClO�����ɼ������غ㣺n��KCl��+n��KClO��=n��KOH������n��KClO��=
n��KOH��=
a mol��ת�Ƶ�����С���ʵ���=
a mol��1=
a mol���ʷ�Ӧ��ת�Ƶ��ӵ����ʵ���ne�ķ�Χ��
a mol��ne��
a mol����C��ȷ��
D����������ֻ��KClO3ʱ�������ʵ��������C�м����֪��n�����KClO3��=
n��KOH��=
a mol����D����
��ѡD��
| c(Cl-) |
| c(ClO-) |
| c(ClO-) |
| c(ClO3-) |
| 1 |
| 2 |
B����Clԭ���غ��֪��2n��Cl2��=n��KCl��+n��KClO��+n��KClO3�����ɼ������غ��֪n��KCl��+n��KClO��+n��KClO3��=n��KOH�����ʲμӷ�Ӧ�����������ʵ���=
| 1 |
| 2 |
| 1 |
| 2 |
C����������ֻ��KClO3ʱ��ת�Ƶ�����࣬���ݵ���ת���غ�n��KCl��=5��KClO3�����ɼ������غ㣺n��KCl��+n��KClO3��=n��KOH������n��KClO3��=
| 1 |
| 6 |
| 1 |
| 6 |
| 1 |
| 6 |
| 5 |
| 6 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 5 |
| 6 |
D����������ֻ��KClO3ʱ�������ʵ��������C�м����֪��n�����KClO3��=
| 1 |
| 6 |
| 1 |
| 6 |
��ѡD��
���������⿼��������ԭ��Ӧ���㣬�Ѷ��еȣ�ע�����ת���غ㼰������Ӧ�ã�

��ϰ��ϵ�д�
 ʱ�����������ҵԭ���ܳ�����ϵ�д�
ʱ�����������ҵԭ���ܳ�����ϵ�д�
�����Ŀ
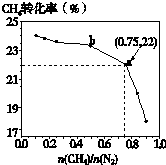 ��֪��3CH4��g��+2N2��g��
��֪��3CH4��g��+2N2��g��| 700�� |
| ���� |
| n(CH4) |
| n(N2) |
A��
| ||
B��
| ||
| C��b���Ӧ��ƽ�ⳣ����a��Ĵ� | ||
| D��a���Ӧ��NH3���������ԼΪ26% |
ͨ������£���A��BΪ���ӣ�C��EΪ�����ӣ�DΪ�����ӣ����Ƕ�����10�����ӣ�B����A�����õ����ʿɵ����C��D��A��B��E��������Ӧ��ɵ�C��һ�ְ�ɫ������������E�ǣ�������
| A��������Al3+��Ҳ������Mg2+ |
| B��ֻ����Al3+ |
| C��ֻ����Mg2+ |
| D������˵�������� |
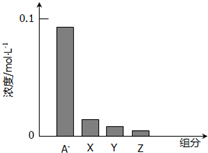 �����£�0.2mol/L��һԪ��HA���Ũ�ȵ�NaOH��Һ�������Ϻ�������Һ�в�������ּ�Ũ����ͼ��ʾ������˵����ȷ���ǣ�������
�����£�0.2mol/L��һԪ��HA���Ũ�ȵ�NaOH��Һ�������Ϻ�������Һ�в�������ּ�Ũ����ͼ��ʾ������˵����ȷ���ǣ�������| A��HAΪǿ�� |
| B���û��ҺpH=7 |
| C��ͼ��X��ʾHA��Y��ʾOH-��Z��ʾH+ |
| D���û����Һ�У�c��A-��+c��Y��=c��Na+�� |
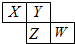 ��ͼ��ʾ��Ԫ�����ڱ���һ���֣�X��Y��Z��W��Ϊ������Ԫ�أ���wԭ�����������������ڲ��������
��ͼ��ʾ��Ԫ�����ڱ���һ���֣�X��Y��Z��W��Ϊ������Ԫ�أ���wԭ�����������������ڲ��������| 7 |
| 10 |
| A��XY2��ZY2��������������Ҫ���� |
| B��YԪ�ص�����ͬ���������ڳ����¶������� |
| C������������Ӧˮ���������W��Z |
| D���⻯��ķе㣺HnZ ����HnY |