题目内容
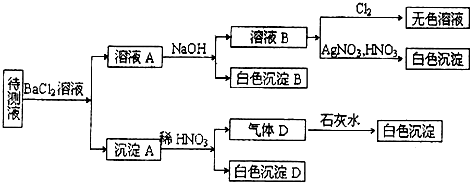
某溶液中只大量含有下列部分离子:K+、Fe3+、Ba2+、Al3+、Cl-、HCO3-、SO42-.现做以下实验:
(1)将溶液滴在蓝色石蕊试纸上,试纸呈红色;
(2)取少量溶液,加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀;
(3)将(2)中的沉淀过滤.由滤液中加入硝酸银溶液,产生白色沉淀;
(4)另取溶液,逐滴加入氢氧化钠溶液至过量,观察到有红褐色沉淀生成,且沉淀量不减少.由此可以推断:
(1)溶液中肯定存在的离子有: .
(2)溶液中肯定不存在的离子有: .
(3)溶液中还不能确定是否存在的离子有: .
(1)将溶液滴在蓝色石蕊试纸上,试纸呈红色;
(2)取少量溶液,加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀;
(3)将(2)中的沉淀过滤.由滤液中加入硝酸银溶液,产生白色沉淀;
(4)另取溶液,逐滴加入氢氧化钠溶液至过量,观察到有红褐色沉淀生成,且沉淀量不减少.由此可以推断:
(1)溶液中肯定存在的离子有:
(2)溶液中肯定不存在的离子有:
(3)溶液中还不能确定是否存在的离子有:
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:(1)溶液滴在蓝色石蕊试纸上,试纸呈红色,说明溶液呈酸性,则一定不存在HCO3-;
(2)取少量溶液,加入硝酸酸化的氯化钡溶液,产生白色沉淀,该沉淀只能是BaSO4;
(3)将(2)中的沉淀滤出,滤液中加入硝酸银溶液,生成白色沉淀,该沉淀是AgCl,但不能证明含有C1-;
(4)另取溶液,逐滴加入氢氧化钠溶液至过量,观察到有红褐色沉淀生成,且沉淀量不减少,说明原溶液中含有Fe3+,一定不存在Al3+.
(2)取少量溶液,加入硝酸酸化的氯化钡溶液,产生白色沉淀,该沉淀只能是BaSO4;
(3)将(2)中的沉淀滤出,滤液中加入硝酸银溶液,生成白色沉淀,该沉淀是AgCl,但不能证明含有C1-;
(4)另取溶液,逐滴加入氢氧化钠溶液至过量,观察到有红褐色沉淀生成,且沉淀量不减少,说明原溶液中含有Fe3+,一定不存在Al3+.
解答:
解:根据(1)可知溶液呈酸性,则原溶液中一定不会存在HCO3-;
根据(2)可知,该沉淀只能为BaSO4,说明溶液中含有SO42-,则一定不存在Ba2+;
(3)该沉淀是AgCl,但由于在(2)操作中加入氯化钡,不能证明原溶液中含有C1-;
根据(4)可知,红褐色沉淀为氢氧化铁,原溶液中含有Fe3+,由于沉淀质量不减少,则一定不存在Al3+;
(1)根据以上分析可知,溶液中肯定存在的离子为:Fe3+、SO42-,
故答案为:Fe3+、SO42-;
(2)根据以上分析可知,原溶液中一定不存在的离子为:Al3+、HCO3-、Ba2+,
故答案为:Al3+、HCO3-、Ba2+;
(3)由于该实验没有涉及到K+离子,则不能证明K+离子是否存在;由于在(2)操作中加入氯化钡,不能证明原溶液中含有C1-,
故答案为:K+、C1-.
根据(2)可知,该沉淀只能为BaSO4,说明溶液中含有SO42-,则一定不存在Ba2+;
(3)该沉淀是AgCl,但由于在(2)操作中加入氯化钡,不能证明原溶液中含有C1-;
根据(4)可知,红褐色沉淀为氢氧化铁,原溶液中含有Fe3+,由于沉淀质量不减少,则一定不存在Al3+;
(1)根据以上分析可知,溶液中肯定存在的离子为:Fe3+、SO42-,
故答案为:Fe3+、SO42-;
(2)根据以上分析可知,原溶液中一定不存在的离子为:Al3+、HCO3-、Ba2+,
故答案为:Al3+、HCO3-、Ba2+;
(3)由于该实验没有涉及到K+离子,则不能证明K+离子是否存在;由于在(2)操作中加入氯化钡,不能证明原溶液中含有C1-,
故答案为:K+、C1-.
点评:本题考查离子的检验和推断,题目难度中等,注意把握离子反应的实验现象以及离子的检验的实验操作方法,注意题干信息(3)为易错点,需要考虑氯化钡溶液的干扰.

练习册系列答案
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
下列说法中,不正确的是( )
| A、恒容密闭容器中进行反应:2A2(g)+B2(g)?2A2B(g);△H<0,达到化学平衡后,加热会使逆反应速率大于正反应速率 |
| B、在常温下,用惰性电极电解饱和Na2CO3溶液,Na2CO3溶液的浓度不变 |
| C、使用催化剂能够改变反应历程,增大反应物分子的接触面积,从而加快反应速率 |
| D、放热或熵增过程自发进行的可能性比吸热或熵减过程要大 |
下列说法正确的是( )
| A、蛋白质及其水解产物都具有两性 |
| B、淀粉和油脂都是可水解的高分子化合物 |
| C、鸡蛋清溶液中加入饱和Na2SO4溶液有沉淀生成是因为蛋白质变性 |
| D、在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
分子式为C9H12O,苯环上有两个取代基且含羟基的化合物,其可能的结构有( )
| A、9种 | B、12种 |
| C、15种 | D、16种 |
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: