题目内容
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为1NA |
| B、64g SO2含有氧原子数为2NA |
| C、标准状况下,22.4L H2O的分子数为1NA |
| D、常温常压下,14g N2含有分子数为0.5NA |
考点:阿伏加德罗常数
专题:
分析:A.缺少氯化镁溶液的体积,无法计算溶液中氯化镁的物质的量;
B.64g二氧化硫的物质的量为1mol,1mol二氧化硫含有2mol氧原子;
C.标况下水的状态不是气体,不能使用标况下的气体摩尔体积计算水的物质的量;
D.14g氮气的物质的量为0.5mol,根据N=n计算出含有的分子数NA.
B.64g二氧化硫的物质的量为1mol,1mol二氧化硫含有2mol氧原子;
C.标况下水的状态不是气体,不能使用标况下的气体摩尔体积计算水的物质的量;
D.14g氮气的物质的量为0.5mol,根据N=n计算出含有的分子数NA.
解答:
解:A.没有告诉该氯化镁溶液的体积,无法根据n=cV计算氯化镁的物质的量,故A错误;
B.64g二氧化硫的物质的量为:
=1mol,1mol二氧化硫中含有氧原子的物质的量为2mol,含有氧原子数为2NA,故B正确;
C.标况下水的状态不是气体,不能使用气体摩尔体积计算22.4L水的物质的量,故C错误;
D.14g氮气的物质的量为:
=0.5mol,0.5mol氮气的分子数为0.5NA,故D正确;
故选BD.
B.64g二氧化硫的物质的量为:
| 64g |
| 64g/mol |
C.标况下水的状态不是气体,不能使用气体摩尔体积计算22.4L水的物质的量,故C错误;
D.14g氮气的物质的量为:
| 14g |
| 28g/mol |
故选BD.
点评:本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下水、乙醇、三氧化硫、氟化氢等物质的状态不是气体.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
同一主族的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性强弱是H3XO4<H3YO4<H3ZO4,下列推断正确的是( )
| A、原子序数:X<Y<Z |
| B、气态氢化物稳定性:XH3<YH3<ZH3 |
| C、元素的非金属性强弱:X>Y>Z |
| D、电子层数:X<Y<Z |
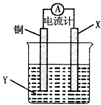 根据反应为 2Cu+O2+CO2+H2O=Cu2(OH)2CO3,设计如图所示原电池,下列说法错误的是( )
根据反应为 2Cu+O2+CO2+H2O=Cu2(OH)2CO3,设计如图所示原电池,下列说法错误的是( )| A、X可以是银或石墨 |
| B、电子从铜电极经外电路流向X电极 |
| C、Y是硫酸铜溶液 |
| D、X极上的电极反应式为 O2+2H2O+4e-=4OH- |
某种气体的摩尔质量为M g?mol-1,将标况下的该气体V L溶解在1000g水中,该气体不与水反应,所得溶液密度为ρ g?cm-3,则所得溶液中溶质的物质的量浓度为( ) mol?L-1.
A、
| ||
B、
| ||
C、
| ||
D、
|
设NA是阿伏加德罗常数的值,下列说法正确的是( )
| A、在32 g18O2中含有2NA个氧原子 |
| B、1molCl2与足量的铁反应转移的电子数与1mol铁与足量的Cl2反应转移的电子数相等 |
| C、某温度下纯水的pH=6,该温度下10LpH=11的NaOH溶液中含OH-的数目为NA |
| D、一定条件下,将1 mol N2与3 mol H2混合反应后,生成NH3分子的数目为2NA |
下列电离方程式正确的是( )
| A、CH3COOH=CH3COO-+H+ |
| B、H2SO4=2H++SO42- |
| C、Ba(OH)2=Ba2++(OH-)2 |
| D、KHCO3=K++H++CO32- |
根据中央气象台报道,近年每到秋末冬初季节,西安市多次出现大雾天气,致使高速公路关闭,航班停飞.雾属于下列分散系中的( )
| A、溶液 | B、悬浊液 |
| C、胶体 | D、乳浊液 |

 ”结构的共有
”结构的共有