题目内容
7.已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子排布相同,则下列关系式正确的是( )| A. | a=b+m+n | B. | a=b-m+n | C. | a=b+m-n | D. | a=b-m-n |
分析 阳离子核外电子数=核电荷数-离子所带电荷数,阴离子核外电子数=核电荷数+离子所带电荷数,以此解答该题.
解答 解:在原子中,核电荷数等于核外电子数;
在阳离子中,核电荷数减去离子所带电荷数等于核外电子数;
在阴离子中,核电荷数加上离子所带电荷数等于核外电子数.
因为Xm+和Yn-具有相同的核外电子排布,
所以,Xm+和Yn-具有相同的核外电子数,
aXm+的核外电子数等于a-m,bYn-的核外电子数为:b+n,
则:a=b+m+n.
故选A.
点评 本题考查离子核电荷数、核外电子与离子电荷数关系,侧重对基础知识的理解巩固,注意在原子中,核电荷数等于核外电子数;在阳离子中,核电荷数减去离子所带电荷数等于核外电子数;在阴离子中,核电荷数加上离子所带电荷数等于核外电子数,难度不大.

练习册系列答案
相关题目
19.下列有关丙烯醛( CH2=CH-CHO)的叙述中,不正确的是( )
| A. | 可使溴水溶液褪色 | B. | 不能与酸性高锰酸钾溶液反应 | ||
| C. | 能发生银镜反应 | D. | 一定条件下能发生加聚反应 |
20.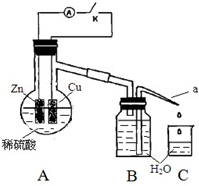 某同学分析Zn 与稀H2SO4的反应.
某同学分析Zn 与稀H2SO4的反应.
(1)该反应的离子方程式是Zn+2H+=Zn2++H2↑.
(2)制H2时,用稀硫酸而不用浓硫酸,原因是浓H2SO4具有强氧化性,不能生成氢气.
(3)已知:Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s)△H=-332kJ/mol
ZnO(s)+H2SO4(aq)═ZnSO4(aq)+H2O(l)△H=-112kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286kJ/mol 则Zn 与稀H2SO4反应生成1mol H2时的反应热△H=kJ/mol.
(4)该同学用如下装置进行实验,分析影响反应速率的因素.
实验时,从断开K 开始,每间隔1 分钟,交替断开或闭合K,并连续计数每1 分钟内从a 管流出的水滴数,得到的水滴数如下表所示:
分析反应过程中的水滴数,请回答:
①由水滴数58>34、81>59,说明在反应初期,闭合K 时比断开K 时的反应速率快(填“快”或“慢”),主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K 时的反应速率快于闭合K 时的反应速率,主要原因是断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+).
③从能量转换形式不同的角度,分析水滴数86>81、117>112 的主要原因是断开K时,反应的化学能主要转化成热能;闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.
 某同学分析Zn 与稀H2SO4的反应.
某同学分析Zn 与稀H2SO4的反应.(1)该反应的离子方程式是Zn+2H+=Zn2++H2↑.
(2)制H2时,用稀硫酸而不用浓硫酸,原因是浓H2SO4具有强氧化性,不能生成氢气.
(3)已知:Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s)△H=-332kJ/mol
ZnO(s)+H2SO4(aq)═ZnSO4(aq)+H2O(l)△H=-112kJ/mol
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286kJ/mol 则Zn 与稀H2SO4反应生成1mol H2时的反应热△H=kJ/mol.
(4)该同学用如下装置进行实验,分析影响反应速率的因素.
实验时,从断开K 开始,每间隔1 分钟,交替断开或闭合K,并连续计数每1 分钟内从a 管流出的水滴数,得到的水滴数如下表所示:
| 1 分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1 分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
①由水滴数58>34、81>59,说明在反应初期,闭合K 时比断开K 时的反应速率快(填“快”或“慢”),主要原因是形成原电池反应速度快.
②由水滴数102>78,说明在反应后期,断开K 时的反应速率快于闭合K 时的反应速率,主要原因是断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+).
③从能量转换形式不同的角度,分析水滴数86>81、117>112 的主要原因是断开K时,反应的化学能主要转化成热能;闭合K时,反应的化学能主要转化成电能,前者使溶液的温度升得更高,故反应速率更快.
2. 如图表示298K时N2与H2反应过程中的能量变化.根据图示下列叙述正确的是( )
如图表示298K时N2与H2反应过程中的能量变化.根据图示下列叙述正确的是( )
 如图表示298K时N2与H2反应过程中的能量变化.根据图示下列叙述正确的是( )
如图表示298K时N2与H2反应过程中的能量变化.根据图示下列叙述正确的是( )| A. | 该反应的热化学方程式为 N2(g)+3H2(g)?2NH3(g),△H=-192kJ•mol-1 | |
| B. | 不用催化剂,生成 1molNH3放出的热量为92kJ | |
| C. | 曲线b表明加入催化剂,反应热减小 | |
| D. | 曲线b表明加入催化剂,反应速率加快 |
19.下列事实不能用勒沙特列原理解释的是( )
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 加入催化剂有利于氨的氧化反应 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
16.短周期中有X、Y、Z三种元素,Z可分别与X、Y组成化合物XZ2、ZY2,这三种元素原 子的核外电子数之和为30,每个XZ2分子的核外电子总数为38,由此可推知X、Y、Z依次为( )
| A. | C、O、S | B. | N、Na、Mg | C. | C、F、P | D. | N、O、P |