题目内容
5.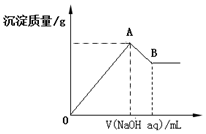 在含有0.60molCl-、0.80molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响).若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x.
在含有0.60molCl-、0.80molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响).若反应前Al3+的物质的量为a mol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x.(1)用a表示x的表达式x=$\frac{2a}{5-a}$
(2)若a为0.20mol,B点横坐标为2000mL时,c(NaOH)=1.2mol/L .
分析 (1)溶液中Al3+的物质的量为a mol,利用电荷守恒用a表示出Mg2+的物质的量,溶液中离子总的物质的量为三种离子之和,得到x和a的关系;
(2)根据铝元素守恒计算氢氧化铝溶解消耗的氢氧化钠的物质的量,再计算镁离子的物质的量以及消耗的氢氧化钠,进而计算浓度即可.
解答 解:(1)Al3+的物质的量为a mol,根据电荷守恒:n(Cl-)+2n(SO42-)=2n(Mg2+)+3n(Al3+),解得2n(Mg2+)=0.6mol+1.6mol-3amol=(2.2-3a)mol,n(Mg2+)=(1.1-1.5a)mol,所以Al3+的物质的量与混合溶液中离子总物质的量的比值为x,即x=$\frac{a}{a+0.6+0.8+1.1-1.5a}$=$\frac{2a}{5-a}$;
故答案为:x=$\frac{2a}{5-a}$;
(2)若a为0.20mol,Al3+的物质的量为a mol,最终消耗氢氧化钠是4amol,即0.8mol,n(Mg2+)=(1.1-1.5a)=0.8mol,镁离子消耗氢氧化钠是1.6mol,共消耗氢氧化钠是2.4mol,所以若B点横坐标为2000mL时,c(NaOH)=$\frac{n}{V}$=$\frac{2.4mol}{2L}$=1.2mol/L;
故答案为:1.2mol/L.
点评 本题考查混合物的有关计算,题目难度中等,注意电荷守恒在计算中的应用,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
15.下列图象正确的是( )
| A. | 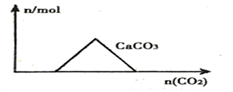 向Ca(OH)2和NaOH的混合溶液中通入CO2 | |
| B. | 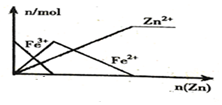 向FeCl3溶液中加入锌粉 | |
| C. | 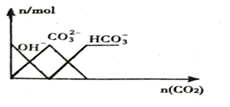 向NaOH溶液中通入CO2 | |
| D. | 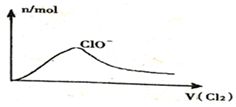 Cl2通入NaOH溶液中 |
10.有些古文或谚语包含了丰富的化学知识,从化学角度解释下列古文或谚语,其中不正确的是的是( )
| 选项 | 古文或谚语 | 化学解释 |
| A | 蜡炬成灰泪始干 | “泪”就是蜡烛燃烧产生的水 |
| B | 以曾青涂铁,铁赤色如铜 | 置换反应 |
| C | 真金不怕火炼 | 金的活动性顺序排最后,性质稳定 |
| D | 野火烧不尽,春风吹又生 | 涉及氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
8.下面是人们对于化学科学的各种常见认识,其中正确的是( )
| A. | 实验是认知化学的唯一手段 | |
| B. | 化学是一门具有较强实用性的科学 | |
| C. | 化学支持高新技术的快速发展,但面对伪科学和人体健康等问题却显得无能为力 | |
| D. | 分子是化学变化中的最小微粒 |

 亚硝酸钠(NaNO,)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和过氧化钠为原料制备亚硝酸钠的装置如图所示.
亚硝酸钠(NaNO,)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和过氧化钠为原料制备亚硝酸钠的装置如图所示.