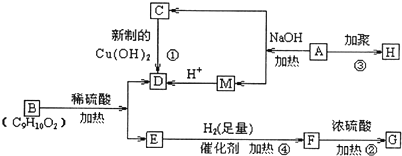
题目内容
镁、铝、铁及其化合物在生产、生活中有着广泛的应用实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如图:
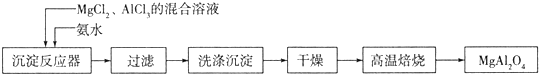
(1)已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34,该温度下向浓度均为0.01mol?L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成 沉淀(填化学式).
(2)高温焙烧时发生反应的化学方程式 ,洗涤沉淀时的方法是 .
(3)常温下如果向AlCl3饱和溶液中不断通人HCl气体,可析出AlCl3?6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: .

(1)已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34,该温度下向浓度均为0.01mol?L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成
(2)高温焙烧时发生反应的化学方程式
(3)常温下如果向AlCl3饱和溶液中不断通人HCl气体,可析出AlCl3?6H2O晶体,结合化学平衡移动原理解释析出晶体的原因:
考点:金属的回收与环境、资源保护
专题:实验设计题
分析:(1)难溶电解质的溶度积越小,加入氨水时越易生成沉淀;
(2)经分析沉淀为Al(OH)3和Mg(OH)2,高温焙烧备MgAl2O4时发生反应的化学方程式2Al(OH)3+Mg(OH)2
MgAl2O4+4H2O,洗涤沉淀时的方法是向漏斗中加水至浸没沉淀,待水自然流干后,再重复2-3次;
(3)氯化氢抑制氯化铝溶液的水解,据此解答即可.
(2)经分析沉淀为Al(OH)3和Mg(OH)2,高温焙烧备MgAl2O4时发生反应的化学方程式2Al(OH)3+Mg(OH)2
| ||
(3)氯化氢抑制氯化铝溶液的水解,据此解答即可.
解答:
解:(1)难溶电解质的溶度积越小,加入氨水时越易生成沉淀,已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34,氢氧化铝先沉淀,
故答案为:Al(OH)3;
(2)经分析沉淀为Al(OH)3和Mg(OH)2,高温焙烧备MgAl2O4时发生反应的化学方程式2Al(OH)3+Mg(OH)2
MgAl2O4+4H2O,洗涤沉淀时的方法是向漏斗中加水至浸没沉淀,待水自然流干后,再重复2-3次,
故答案为:2Al(OH)3+Mg(OH)2
MgAl2O4+4H2O; 向漏斗中加水至浸没沉淀,待水自然流干后,再重复2-3次;
(3)氯化铝在溶液中存在溶解平衡,通入氯化氢后溶液中氯离子浓度增大,抑制氯化铝溶解,所以促进氯化铝晶体析出,
故答案为:AlCl3饱和溶液中存在溶解平衡:AlCl3?6H2O(s)?Al3+(aq)+3Cl-(aq)+6H2O(l),通入HCl气体使溶液中c(Cl-)增大,平衡向析出固体的方向移动从而析出AlCl3晶体.
故答案为:Al(OH)3;
(2)经分析沉淀为Al(OH)3和Mg(OH)2,高温焙烧备MgAl2O4时发生反应的化学方程式2Al(OH)3+Mg(OH)2
| ||
故答案为:2Al(OH)3+Mg(OH)2
| ||
(3)氯化铝在溶液中存在溶解平衡,通入氯化氢后溶液中氯离子浓度增大,抑制氯化铝溶解,所以促进氯化铝晶体析出,
故答案为:AlCl3饱和溶液中存在溶解平衡:AlCl3?6H2O(s)?Al3+(aq)+3Cl-(aq)+6H2O(l),通入HCl气体使溶液中c(Cl-)增大,平衡向析出固体的方向移动从而析出AlCl3晶体.
点评:本题考查了物质的分离与提纯、实验方案的设计、元素化合物知识的综合运用等,属于拼合型题目,对学生的心理有较高的要求,掌握基础是关键,难度中等.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、碱金属元素在自然界以化合态形式存在 |
| B、金属铷投入水中会发生爆炸式反应,生成氢氧化铷和氢气 |
| C、碱金属与氧气反应,生成物都不随反应条件或反应物的用量变化而变化 |
| D、金属铯的密度大于钠,而钠的熔点高于铯 |
下列有关原子、分子的说法错误的是( )
| A、原子、分子都是构成物质的微粒 |
| B、原子、分子总在不断运动 |
| C、分子可以再分,原子不能再分 |
| D、分子间有一定的间隔 |