题目内容
有A、B、C三种可溶性正盐,阴、阳离子各不相同,其阴离子的摩尔质量依次增大(按A、B、C的顺序),将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO42-、NO
、Cl-五种离子(不考虑难溶物自身的溶解),同时生成一种阴、阳离子个数比为1:1的白色沉淀.请回答下列问题:
(1)经检验,三种正盐中还含有下列选项中的一种离子,该离子是 .
A.Na+ B.Mg2+C.Cu2+ D.Ag+
(2)三种正盐的化学式分别是:A ,B ,C .
(3)A、B、C同时溶于水时反应的离子方程式为 .
- 3 |
(1)经检验,三种正盐中还含有下列选项中的一种离子,该离子是
A.Na+ B.Mg2+C.Cu2+ D.Ag+
(2)三种正盐的化学式分别是:A
(3)A、B、C同时溶于水时反应的离子方程式为
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO42-、NO3-、Cl-五种离子,同时生成一种白色沉淀,A、B、C三种可溶性正盐,阴、阳离子各不相同,其阴离子的摩尔质量依次增大,则A为盐酸盐,B为硝酸银,C为硫酸盐;等物质的量混合,生成沉淀可能为AgCl,则A为FeCl3,B为AgNO3,C为K2SO4,以此来解答.
解答:
解:等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、K+、SO42-、NO3-、Cl-五种离子,同时生成一种白色沉淀,A、B、C三种可溶性正盐,阴、阳离子各不相同,其阴离子的摩尔质量依次增大,则A为盐酸盐,B为硝酸银,C为硫酸盐;等物质的量混合,生成沉淀可能为AgCl,则A为FeCl3,B为AgNO3,C为K2SO4,
(1)所给离子中只有Ag+和SO42-、NO
、Cl-三种阴离子中Cl-按1:1生成沉淀,其余所给阳离子均和三种阴离子不沉淀,故选D;
故答案为:D;
(2)由上述分析可知,A为FeCl3,B为AgNO3,C为K2SO4,故答案为:FeCl3;AgNO3;K2SO4;
(3)等物质的量的FeCl3、AgNO3、K2SO4溶于水,Ag+和Cl-按1:1生成沉淀氯化银沉淀,反应的离子方程式为:Ag++Cl-═AgCl↓;
故答案为:Ag++Cl-═AgCl↓.
(1)所给离子中只有Ag+和SO42-、NO
- 3 |
故答案为:D;
(2)由上述分析可知,A为FeCl3,B为AgNO3,C为K2SO4,故答案为:FeCl3;AgNO3;K2SO4;
(3)等物质的量的FeCl3、AgNO3、K2SO4溶于水,Ag+和Cl-按1:1生成沉淀氯化银沉淀,反应的离子方程式为:Ag++Cl-═AgCl↓;
故答案为:Ag++Cl-═AgCl↓.
点评:本题考查物质检验和鉴别的实验方案的设计,为高频考点,注意三种阴离子的摩尔质量推断物质为解答的关键,侧重分析能力及推断能力的考查,题目难度中等.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
 如图是某学校实验室从化学试剂商店买同的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
如图是某学校实验室从化学试剂商店买同的硫酸试剂标签上的部分内容.据此下列说法正确的是( )| A、该硫酸的物质的量浓度为1.84mol/L |
| B、1mol Zn与足量的该硫酸反应产生2gH2 |
| C、配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL |
| D、该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L |
下列说法正确的是( )
| A、双原子分子中化学键键角越大,分子越稳定 |
| B、共价键都具有饱和性、方向性 |
| C、在分子中,两个成键的原子间的距离叫键长 |
| D、已知H-H键能为436 kJ?mol-1,H-N键能为391 kJ?mol-1,根据化学方程式N2(g)+3H2(g)═2NH3(g),△H=-92.4 kJ?mol-1,则N≡N键的键能是945.6 kJ?mol-1 |



 )
)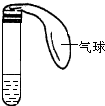 某学生课外活动小组利用如图所示装置分别做如下实验:在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是
某学生课外活动小组利用如图所示装置分别做如下实验:在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是