题目内容
18.某原电池的总反应是Zn+Cu2+=Zn2++Cu,该原电池的正确组成是( )| 选项 | A | B | C | D |
| 正极材料 | Zn | Cu | Zn | Cu |
| 负极材料 | Cu | Zn | Cu | Zn |
| 电解质溶液 | CuCl2 | CuSO4 | ZnSO4 | ZnCl2 |
| A. | A | B. | B | C. | C | D. | D |
分析 根据电池反应式Zn+Cu2+=Zn2++Cu知,Zn失电子化合价升高作负极,不如锌活泼的金属或导电的非金属作正极,铜离子得电子发生还原反应,则可溶性铜盐溶液作电解质溶液,据此分析解答.
解答 解:根据电池反应式知,Zn失电子化合价升高作负极,不如锌活泼的金属或导电的非金属作正极,铜离子得电子发生还原反应,则可溶性铜盐溶液作电解质溶液,
A.应该是Zn作负极、Cu作正极,故A错误;
B.Zn作负极、Cu作正极、硫酸铜溶液作电解质溶液可以实现该原电池反应,故B正确;
C.应该是锌作负极、Cu作正极,氯化铜或硫酸铜溶液作电解质溶液,故C错误;
D.应该用可溶性铜盐溶液作电解质溶液,不能用硫酸锌溶液作电解质溶液,否则不能自发进行氧化还原反应而不能构成原电池,故D错误;
故选C.
点评 本题考查了原电池工作原理,题目难度不大,明确电池反应中得失电子的物质与正负极材料、电解质溶液的关系是解本题关键,注意熟练掌握原电池工作原理,试题培养了学生的灵活应用能力.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
8.下列说法中正确的是( )
| A. | 向鸡蛋清溶液中滴加少量硫酸铵溶液,会影响蛋白质的活性 | |
| B. | 可以利用丁达尔效应来鉴别葡萄糖和淀粉溶液 | |
| C. | 加酶洗衣粉可用来洗涤棉织品、毛织品、腈纶织品和涤纶织品 | |
| D. | 合成聚乙烯塑料、聚氯乙烯塑料、酚醛塑料和聚苯乙烯塑料所发生的反应类型相同 |
6.下列气体中,在标准状况下体积最小的是( )
| A. | 0.4 mol NO2 | B. | 4g O2 | C. | 0.9 g H2 | D. | 11.2 L CH4 |
13.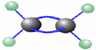 如图是某有机物分子的球棍式模型,其中大球代表碳原子,小球代表氢原子,短棍代表共价键,该有机物的名称是( )
如图是某有机物分子的球棍式模型,其中大球代表碳原子,小球代表氢原子,短棍代表共价键,该有机物的名称是( )
 如图是某有机物分子的球棍式模型,其中大球代表碳原子,小球代表氢原子,短棍代表共价键,该有机物的名称是( )
如图是某有机物分子的球棍式模型,其中大球代表碳原子,小球代表氢原子,短棍代表共价键,该有机物的名称是( )| A. | 乙烯 | B. | 乙烷 | C. | 乙醇 | D. | 乙炔 |
3.短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A与C同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是( )
| A. | 原子半径B<A<C | |
| B. | A的氢化物的稳定性大于C的氢化物 | |
| C. | A的氧化物是离子化合物,B的氧化物是共价化合物 | |
| D. | A与C可形成离子化合物 |
10.分子式为C7H8O并能与金属钠反应放出氢气的芳香族有机化合物有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
7.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4 L水中含有的分子数为NA | |
| B. | 2L 0.5 mol/L的CH3COOH溶液中,含有CH3COO-离子个数为 NA | |
| C. | 常温常压下,3.4 g NH3含有原子的数目为0.8NA | |
| D. | 78 g Na2O2与足量水反应转移的电子数目为NA |
8.下列有关实验的操作、原理和现象的叙述正确的是( )
| A. | 在4mL0.1mol•L-1的K2Cr2O7溶液中滴加数滴1mol•L-1的NaOH溶液,溶液颜色从橙色变成黄色 | |
| B. | 配制0.1 mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 | |
| C. | 用干燥且洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH值 | |
| D. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用,迅速混合后测出初始温度,用环形玻璃搅拌棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3 次的实验平均值等措施,以达到良好的实验效果 |