题目内容
11.3mol CaCl2中含3mol Ca2+,6mol Cl-,共9mol离子.分析 1mol CaCl2中含有1mol的钙离子,2mol的氯离子,共有3mol的离子,由此分析解答.
解答 解:1mol CaCl2中含有1mol的钙离子,2mol的氯离子,共有3mol的离子,所以3mol CaCl2中含 3mol Ca2+,6mol Cl-,共9mol离子,故答案为:3;6;9.
点评 本题考查根据物质的组成,列出关系式示解,学生在解题中要注意格式规范,比较容易.

练习册系列答案
相关题目
1.在如图装置中,若通电一段时间后乙装置左侧电极质量增加,则下列说法错误的是( )
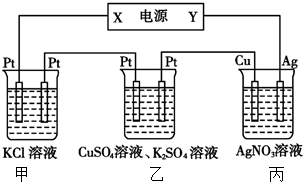

| A. | 当甲装置中共产生标准状况下4.48 L气体时,Cu电极上质量增加43.2g | |
| B. | 电解过程中装置丙的pH无变化 | |
| C. | 向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态 | |
| D. | 乙中左侧电极反应式:Cu2++2e-=Cu |
2.元素X的原子核内只有1个质子.元素Y的阳离子电子层结构和氖原子电子层结构相同,Y、Z和E在周期表里位于同一周期.X和E、Z分别能形成气态氢化物XE和X2Z,它们的水溶液是酸.Z跟Y能形成离子化合物Y2Z.与氖同周期的元素F的气态氢化物FX3,其水溶液能使酚酞试液变红.则X、Y、Z、E、F的元素符号是( )
| A. | H、Na、S、Cl、N | B. | H、Na、S、Br、P | C. | H、Li、O、F、N | D. | H、Mg、S、O、N |
6.铅蓄电池是常见的二次电池,目前汽车上使用的电瓶大多数是铅蓄电池.已知铅蓄电池的电解质溶液为硫酸溶液,其充、放电按下式进行:Pb(s)+PbO2(s)+2H2SO4(aq)$?_{充电}^{放电}$2PbSO4(s)+2H2O(1),下列有关该电池的说法正确的是( )
| A. | 放电时,溶液中H+向PbO2电极迁移 | |
| B. | 放电时,电路中转移0.2mol电子时Pb电极质量减小20.7g | |
| C. | 充电时,电解质溶液的pH增大 | |
| D. | 充电时,阴极的电极反应式为:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
16.常温下,下列有关电解质溶液的说法正确的是( )
| A. | 0.1mol•L-1 Na2SO3溶液加水稀释,c(H+):c(SO32-)的值逐渐减小 | |
| B. | pH为6的碳酸溶液,水电离出的c(H+)=1.0×10-6mol•L-1 | |
| C. | pH为12的氢氧化钡溶液与pH为2的盐酸溶液等体积混合,溶液呈碱性 | |
| D. | 把0.2mol•L-1醋酸与0.1mol•L-1醋酸钠溶液等体积混合c(CH3COOH)+c(CH3COO-)=3c(Na+) |
3.海水是混合物,下列物质中与海水一样没有固定熔点的是( )
| A. | 胆矾 | B. | 冰、水混合物 | C. | 纯净的盐酸 | D. | 水银 |
15.下列对应的表达方式错误的是( )
| A. | Cl-的结构示意图 | B. | 氯化氢分子的电子式: | ||
| C. | 碳-12原子${\;}_{5}^{12}C$ | D. | HClO的结构式H-O-Cl |
16.能使石蕊试液变红,又能使酸性KMnO4试液变为无色澄清溶液,还能使溴水褪色的是( )
| A. | SO2 | B. | H2S | C. | Cl2 | D. | CO |