题目内容
空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下,其中不正确的是( )


| A、溴在周期表中位于第四周期VIIA族 |
| B、步骤①中用硫酸酸化可抑制Cl2、Br2与水反应 |
| C、步骤④的离子方程式Br2+SO2+H2O=2H++2Br-+SO42- |
| D、步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物可用分液漏斗分离 |
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:苦卤中含有溴,在酸性条件下通入氯气,可发生置换反应生成溴单质,吹入空气,将溴分离出来,然后溴与二氧化硫发生反应生成HBr和硫酸,再通入氯气,生成溴,然后分液、蒸馏和得到液溴,以此解答该题.
解答:
解:A.溴的原子序数为35,原子结构中有4个电子层,最外层电子数为7,所以溴在周期表中位于4周期VIIA族,故A正确;
B.步骤②发生2Br-+Cl2=2Cl-+Br2,则步骤①中硫酸可减少副反应的发生,即步骤①中用硫酸酸化可防止Cl2、Br2与水反应,故B正确;
C.步骤④发生SO2+Br2+2H2O=2HBr+H2SO4,离子反应为Br2+SO2+2H2O=4H++2Br-+SO42-,故C错误;
D.实现大量液溴和少量溴水分离的方法是分液法,采用的仪器为分液漏斗,操作时下层液体必须从下口流出,上层液体从上口倒出,故D正确.
故选C.
B.步骤②发生2Br-+Cl2=2Cl-+Br2,则步骤①中硫酸可减少副反应的发生,即步骤①中用硫酸酸化可防止Cl2、Br2与水反应,故B正确;
C.步骤④发生SO2+Br2+2H2O=2HBr+H2SO4,离子反应为Br2+SO2+2H2O=4H++2Br-+SO42-,故C错误;
D.实现大量液溴和少量溴水分离的方法是分液法,采用的仪器为分液漏斗,操作时下层液体必须从下口流出,上层液体从上口倒出,故D正确.
故选C.
点评:本题考查海水提溴,把握流程中发生的化学反应及混合物分离方法为解答的关键,步骤①为解答的难点,注重工业流程和化学反应原理的考查,题目难度中等.

练习册系列答案
相关题目
下列描述所对应的离子方程式正确的是( )
| A、钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+ | ||||
| B、用CuCl2溶液做导电性实验,灯泡发光:CuCl2=Cu2++2Cl- | ||||
| C、铅蓄电池充电时的阳极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42- | ||||
D、用铜做电极电解CuSO4溶液:2Cu2++2H2O
|
实验室制备氨气,检验是否收集满的正确方法是( )
| A、用手扇动收集的气体,有气味则已收集满 |
| B、将润湿的淀粉KI试纸接近瓶口,试纸变蓝则已收集满 |
| C、将润湿的红色石蕊试纸伸入瓶内,试纸变蓝则已收集满 |
| D、用玻璃棒一端蘸取浓盐酸,接近瓶口,产生大量白烟,证明已收集满 |
下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A、酸性氧化物 二氧化碳 CO2 |
| B、酸 硫酸 H2S |
| C、碱性氧化物 氢氧化钙 Ca(OH)2 |
| D、碱 纯碱 NaOH |
IBr的化学性质与卤素单质相似,能与金属反应生成金属卤化物,也可以与水发生如下反应:IBr+H2O=HIO+HBr 下列说法正确的是( )
| A、在IBr中,碘和溴的化合价均为零 |
| B、IBr与水反应时,IBr既是氧化剂又是还原剂 |
| C、IBr与钾反应,化学方程式是2K+IBr=KI+KBr |
| D、IBr与Ca(OH)2溶液反应,产物有CaI2、Ca(BrO)2和H2O |
 将1mol I2(g)和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2 (g)?2HI(g);△H<0,并达平衡.HI的物质的量分数w(HI)随时间变化如图曲线(Ⅱ)所示:
将1mol I2(g)和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2 (g)?2HI(g);△H<0,并达平衡.HI的物质的量分数w(HI)随时间变化如图曲线(Ⅱ)所示: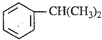 ),是一种重要的有机化工原料.根据题意完成下列填空:
),是一种重要的有机化工原料.根据题意完成下列填空: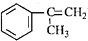 )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法