题目内容
7.1.505×1023个氧气分子为0.25mol,0.1mol氧气共有1.6NA个电子.分析 根据n=$\frac{N}{{N}_{A}}$结合物质的构成特点计算.
解答 解:n(O2)=$\frac{1.505×1{0}^{23}}{6.02×1{0}^{23}/mol}$=0.25mol,
O原子中含有8的电子,则0.1mol氧气共有电子数为0.1mol×2×8×NA=1.6NA,
故答案为:0.25;1.6NA.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的运用以及物质的构成特点,难度不大.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
15.下列各项叙述中一定能说明元素X的非金属性比元素Y的非金属性强的是( )
| A. | X原子在反应中得到的电子数比Y原子在反应中得到的电子数少 | |
| B. | 气态氢化物 Y比X稳定 | |
| C. | X的最高正价比Y的最高正价高 | |
| D. | X单质能与Y的氢化物反应生成Y单质 |
2.下列表述中,合理的是( )
| A. | 准确量取20.00mL高锰酸钾溶液,可选用25 mL碱式滴定管 | |
| B. | 将水加热,Kw增大,pH不变 | |
| C. | 用惰性电极电解1 L浓度均为2 mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2 mol电子转移时,阴极析出6.4g金属 | |
| D. | CuSO4 的水溶液经加热浓缩、蒸干灼烧后能得到CuSO4固体 |
5.下列离子方程式书写正确的是( )
| A. | Ba(OH)2溶液与稀H2SO4反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| B. | 往FeCl3溶液中加入Cu粉:Fe3++Cu═Fe2++Cu2+ | |
| C. | Al(OH)3沉淀中滴加盐酸 Al(OH)3+3H+═Al3++3H2O | |
| D. | FeCl2溶液中通入Cl2:2Fe2++Cl2═2Fe3++2Cl- |
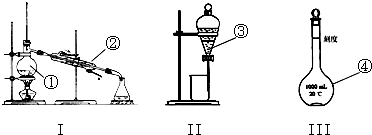

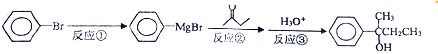
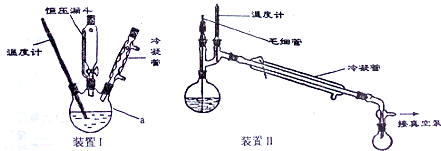
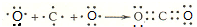 .
.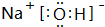 ,其中存在的化学键有离子键、共价键.
,其中存在的化学键有离子键、共价键.