题目内容
2.下列表述中,合理的是( )| A. | 准确量取20.00mL高锰酸钾溶液,可选用25 mL碱式滴定管 | |
| B. | 将水加热,Kw增大,pH不变 | |
| C. | 用惰性电极电解1 L浓度均为2 mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2 mol电子转移时,阴极析出6.4g金属 | |
| D. | CuSO4 的水溶液经加热浓缩、蒸干灼烧后能得到CuSO4固体 |
分析 A、高锰酸钾溶液具有强氧化性能腐蚀碱式滴定管;
B、加热促进水的电离;
C、根据阳离子的放电顺序判断;
D、硫酸是不挥发的酸.
解答 解:A、高锰酸钾溶液具有强氧化性能腐蚀碱式滴定管,所以量取高锰酸钾溶液应该用酸式滴定管,故A错误;
B、加热促进水的电离,氢离子和氢氧根离子的浓度都增大,Kw增大,pH减小,故B错误;
C、Ag+氧化性大于Cu2+,1L浓度均为2mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2mol电子转移时,首先析出Ag,质量为0.2mol×108g/mol=21.6g,故C错误;
D、硫酸是不挥发的酸,所以CuSO4的水溶液经加热浓缩、蒸干灼烧后能得到CuSO4固体,故D正确;
故选D.
点评 本题考查了水的电离平衡、滴定管的使用、盐的水解等,侧重于基础知识的考查,难度不大.

练习册系列答案
相关题目
12.已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O═4Fe(OH)3↓+O2↑+8Na+,则下列说法正确的是( )
| A. | 该反应中Fe2+是还原剂,O2是还原产物 | |
| B. | 4 mol Na2O2在反应中共得到8NA个电子 | |
| C. | 每生成4 mol Fe(OH)3反应过程中共转移电子6 mol | |
| D. | 反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀 |
13.已知室温时,0.1mo1/L某一元酸HX有0.1%发生电离,下列叙述错误的是( )
| A. | 该溶液的pH=4 | |
| B. | 适当升高温度,溶液的pH不变 | |
| C. | 此酸的电离平衡常数约为1×10-7 | |
| D. | 由HX电离出的c(H+)约为水电离出的c(OH-)的106倍 |
17.下列说法正确的是( )
| A. | 同温同压下,物质的物质的量越大,体积也越大 | |
| B. | 同温同压下,气体的物质的量越大,体积也越大 | |
| C. | 同温同压下,同体积的气体具有相同的原子数 | |
| D. | 体积相同的气体,所含分子数也相同 |
2.某小组利用如图1装置,用苯与溴在FeBr3催化作用下制备溴苯:

反应剧烈进行,烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现,蒸馏水逐渐变成黄色.反应停止后按
如图2流程分离产品:
已知:溴苯难溶于水,与有机溶剂互溶;溴、苯、溴苯的沸点依次为59℃、80℃、156℃.
(1)操作Ⅰ为过滤,操作Ⅱ为蒸馏.
(2)“水洗”、“NaOH溶液洗”需要用到的玻璃仪器是分液漏斗、烧杯.
(3)向“水洗”后所得水相中滴加KSCN溶液,溶液变红色.推测水洗的主要目的是除去FeBr3.
(4)锥形瓶中蒸馏水变黄的原因是溶解了从烧瓶中挥发出的溴.
(5)已知苯与溴发生的是取代反应,推测反应后锥形瓶中液体含有的两种大量离子,并设计实验方案验证你的推测.
(限选试剂:镁条、四氯化碳、氯水、溴水、蒸馏水)


反应剧烈进行,烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现,蒸馏水逐渐变成黄色.反应停止后按
如图2流程分离产品:
已知:溴苯难溶于水,与有机溶剂互溶;溴、苯、溴苯的沸点依次为59℃、80℃、156℃.
(1)操作Ⅰ为过滤,操作Ⅱ为蒸馏.
(2)“水洗”、“NaOH溶液洗”需要用到的玻璃仪器是分液漏斗、烧杯.
(3)向“水洗”后所得水相中滴加KSCN溶液,溶液变红色.推测水洗的主要目的是除去FeBr3.
(4)锥形瓶中蒸馏水变黄的原因是溶解了从烧瓶中挥发出的溴.
(5)已知苯与溴发生的是取代反应,推测反应后锥形瓶中液体含有的两种大量离子,并设计实验方案验证你的推测.
(限选试剂:镁条、四氯化碳、氯水、溴水、蒸馏水)
| 序号 | 实验步骤 | 预期现象 | 结论 |
| 1 | |||
| 2 | 锥形瓶中液体含大量Br- | ||
| 3 | 锥形瓶中液体含大量H+ |

20.下列化学方程式中不正确的是( )
| A. | CH3CH2CH2OH+HBr$→_{H+}^{△}$CH3CH2CH2Br+H2O | |
| B. |  +NaHCO3→ +NaHCO3→ +H2CO3 +H2CO3 | |
| C. |  +CO2+H2O→ +CO2+H2O→ +NaHCO3 +NaHCO3 | |
| D. |  +3Br2→ +3Br2→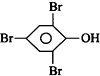 ↓+3HBr ↓+3HBr |

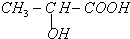 ,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
 .
.