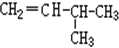题目内容
17.(1)写出图中序号①~④仪器的名称: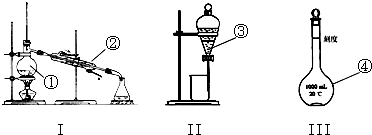
①蒸馏烧瓶;②冷凝管; ③分液漏斗;④1000mL容量瓶;
(2)仪器①~④中,使用前必须检漏的③④.(填仪器序号)
(3)现欲用98%的浓硫酸(密度为1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸100mL.
①所需仪器除烧杯、玻璃棒外还需量筒、100mL容量瓶、胶头滴管.
②下列操作引起所配溶液浓度偏高的是BC
A.用量筒取浓硫酸时俯视
B.将浓硫酸倒出后,洗涤量筒,并将洗涤液倒入烧杯中
C.在烧杯中稀释浓硫酸后,立即转移
D.定容时仰视
E.颠倒摇匀后发现液面低于刻度线,但未加水至刻度线.
分析 (1)根据常见仪器的名称来回答;
(2)分液漏斗和100mL容量瓶在使用前要检查是否漏水;
(3)①根据用浓溶液配制稀溶液的步骤为计算、量取、稀释、冷却、移液、洗涤、定容、摇匀和装瓶来分析所需的仪器;
②分析具体操作对n、V的影响,根据c=$\frac{n}{V}$分析不当操作对溶液浓度的影响.
解答 解:(1)因①~④仪器的名称分别为:蒸馏烧瓶、冷凝管、分液漏斗、1000mL容量瓶,
故答案为:蒸馏烧瓶;冷凝管;分液漏斗;1000mL容量瓶;
(2)因分液漏斗和100mL容量瓶在使用前要检查是否漏水,蒸馏烧瓶、冷凝管不需要检查是否漏水,故答案为:③④;
(3)①用浓溶液配制稀溶液的步骤为计算、量取、稀释、冷却、移液、洗涤、定容、摇匀和装瓶可知所需的仪器为量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,故除烧杯、玻璃棒外还需量筒、100mL容量瓶和胶头滴管,故答案为:量筒、100mL容量瓶、胶头滴管;
②A.用量筒取浓硫酸时俯视,会导致量取的浓硫酸的体积偏小,则所配溶液的浓度偏小,故A错误;
B.将浓硫酸倒出后,洗涤量筒,洗涤液应倒入废液缸中,如果倒入容量瓶中,会导致所取的溶质的物质的量偏多,则溶液浓度偏高,故B正确;
C.在烧杯中稀释浓硫酸后未冷却,立即转移,则待冷却后溶液体积偏小,浓度偏高,故C正确;
D.定容时仰视,则溶液体积偏大,浓度偏低,故D错误;
E.颠倒摇匀后发现液面低于刻度线是正常的,未加水至刻度线是正确的,对浓度无影响,故E错误.
故选BC.
点评 本题考查了配制一定物质的量浓度溶液所需的仪器和误差分析,难度不大,注意根据配制步骤来选择仪器.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
7.下列各组物质中,最简式相同,但既不是同系物,又不是同分异构体的是( )
| A. | 甲醛﹑甲酸甲酯 | B. | 丙烯﹑环丙烷 | C. | 乙酸﹑甲酸甲酯 | D. | 乙烯﹑1-丁烯 |
8.下列溶液中含氧原子最多的是( )
| A. | 10ml1.0 mol•L-1的H2SO4溶液 | B. | 20ml1.0 mol•L-1的Na2CO3溶液 | ||
| C. | 30ml1.0 mol•L-1的HNO3溶液 | D. | 40ml1.0 mol•L-1的NaOH溶液 |
12.已知硫酸亚铁溶液中加入过氧化钠时发生反应:4Fe2++4Na2O2+6H2O═4Fe(OH)3↓+O2↑+8Na+,则下列说法正确的是( )
| A. | 该反应中Fe2+是还原剂,O2是还原产物 | |
| B. | 4 mol Na2O2在反应中共得到8NA个电子 | |
| C. | 每生成4 mol Fe(OH)3反应过程中共转移电子6 mol | |
| D. | 反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀 |
2.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有( )
| A. | 滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、N03- | |
| B. | pH为11的溶液:S2-、SO32-、SO42-、Na+ | |
| C. | 水电离出来的c (H+)=10-13 mol/L的溶液:K+、HCO3一、Br一、Ba2+ | |
| D. | 无色溶液:K+、CO32-、N03-、Ca2+ |
9.黑火药爆炸时可发生如下反应:5S+16KNO3+16C=3K2SO4+4K2CO3+K2S+12CO2↑+8N2↑,下列有关说法正确的是( )
| A. | S既作氧化剂又作还原剂 | B. | 消耗12gC时,反应转移5mol电子 | ||
| C. | 还原产物只有K2S | D. | KNO3只发生氧化反应 |
 ,A的名称是2-甲基戊烷. 若A是炔烃B氢化而成,则B的结构有2种
,A的名称是2-甲基戊烷. 若A是炔烃B氢化而成,则B的结构有2种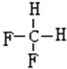 和
和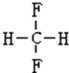 F.
F.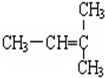 和
和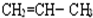 G.
G.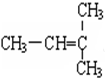 和
和