题目内容
 A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增.已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的
A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增.已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的| 1 |
| 2 |
(1)C单质的电子式
(2)化合物乙中含有的化学键是
(3)化合物甲为固体时属于
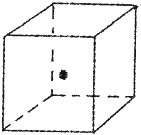
(4)如图立方体中心的“?”表示B单质所形成的原子晶体中的一个原子,请在立方体的顶点用“?”表示出与之紧邻的B原子.
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:B原子核外最外层电子数是次外层电子数的两倍,应为C元素,电子总数是E原子总数的
,则E的原子序数为12,应为Mg元素,F是同周期元素中原子半径最小的元素,位于第三周期,应为Cl元素,D2-与E2+的电子层结构相同,则D应为O,由此可知C为N元素,A是非金属元素,且A、C、F可形成离子化合物乙,可知A为H元素,乙为氯化铵,结合对应单质、化合物的性质解答该题.
| 1 |
| 2 |
解答:
解:B原子核外最外层电子数是次外层电子数的两倍,应为C元素,电子总数是E原子总数的
,则E的原子序数为12,应为Mg元素,F是同周期元素中原子半径最小的元素,位于第三周期,应为Cl元素,D2-与E2+的电子层结构相同,则D应为O,由此可知C为N元素,A是非金属元素,且A、C、F可形成离子化合物乙,可知A为H元素,乙为氯化铵,
(1)由以上分析可知C为N元素,单质的电子式为 ,F为Cl元素,电子排布式为1s22s22p63s23p5,EMg元素,原子核外有3个电子层,最外层电子数为2,原子结构示意图为
,F为Cl元素,电子排布式为1s22s22p63s23p5,EMg元素,原子核外有3个电子层,最外层电子数为2,原子结构示意图为 ,
,
故答案为: ;1s22s22p63s23p5;
;1s22s22p63s23p5; ;
;
(2)乙为氯化铵,为离子化合物,含有离子键、共价键和配位键,故答案为:离子键、共价键和配位键;
(3)C与O可以形成三原子化合物甲,为CO2,为分子晶体,镁在二氧化碳中燃烧生成氧化镁和C,方程式为2Mg+CO2
2MgO+C,
故答案为:分子;2Mg+CO2
2MgO+C;
(4)金刚石为一种空间网状结构的原子晶体,平均每个正四面体中含有四个最近且等距离的碳原子,可表示为: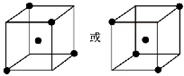 ,
,
故答案为: .
.
| 1 |
| 2 |
(1)由以上分析可知C为N元素,单质的电子式为
 ,F为Cl元素,电子排布式为1s22s22p63s23p5,EMg元素,原子核外有3个电子层,最外层电子数为2,原子结构示意图为
,F为Cl元素,电子排布式为1s22s22p63s23p5,EMg元素,原子核外有3个电子层,最外层电子数为2,原子结构示意图为 ,
,故答案为:
 ;1s22s22p63s23p5;
;1s22s22p63s23p5; ;
;(2)乙为氯化铵,为离子化合物,含有离子键、共价键和配位键,故答案为:离子键、共价键和配位键;
(3)C与O可以形成三原子化合物甲,为CO2,为分子晶体,镁在二氧化碳中燃烧生成氧化镁和C,方程式为2Mg+CO2
| ||
故答案为:分子;2Mg+CO2
| ||
(4)金刚石为一种空间网状结构的原子晶体,平均每个正四面体中含有四个最近且等距离的碳原子,可表示为:
 ,
,故答案为:
 .
.
点评:本题考查位置、结构与性质关系的综合应用,为高考常见题型,元素的推断是解答本题的关键,在推断中抓住“短周期”、“主族”、“核电荷数依次递增”,并注意信息的前后呼应,把握物质的性质,学习中注意积累.

练习册系列答案
相关题目
下列事实与胶体性质无关的是( )
| A、向豆浆中加入盐卤做豆腐 |
| B、长江三角洲、珠江三角洲的形成 |
| C、一束平行光线射入蛋白质溶液里,从侧面可以看到一束光亮的通路 |
| D、向石灰水中通入二氧化碳气体产生白色浑浊 |
在一密闭容器中,反应aA(g)?bB(g)达平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时B的浓度是原来的60%,则( )
| A、平衡向正反应方向移动了 |
| B、平衡向逆反应方向移动了 |
| C、物质A的质量分数增加了 |
| D、b<a |
下列示意图与对应的反应情况符合的是( )
A、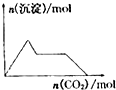 向含0.01mol KOH和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2至过量 |
B、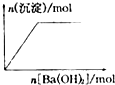 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量 |
C、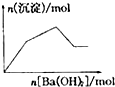 向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量 |
D、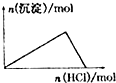 向NaAlO2溶液中逐滴加入盐酸至过量 |
pH=2的两种一元酸HX和HY的溶液分别取50mL,加入过量的镁粉,充分反应后,收集H2的体积在相同状况下分别为V1和V2,若V1>V2,下列说法正确的是( )
| A、HX可能是强酸 |
| B、NaX水溶液的碱性弱于NaY水溶液的碱性 |
| C、HX一定是弱酸 |
| D、反应过程中二者生成H2的速率相同 |