题目内容
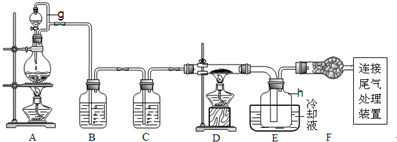
某学生利用以下装置探究Cl2和NH3之间的反应,其中C为纯净干燥的Cl2和NH3反应装置.
请回答下列问题:
(1)如图组装好各装置,各仪器中装入适量药品后,检测装置气密性的方法是 .
(2)装置F中发生反应的离子方程式为 .
(3)通入装置C的两根导气管左边较长,右边较短,目的是 .当C中产生 现象,证明Cl2和NH3发生了反应,生成了 ,用C装置完成实验探究存在缺限,原因是 .
(4)某甲、乙两同学为了探究G口逸出气体的成份,进行如下假设和探究.实验选用试剂有0.1mol/LKI溶液,2%淀粉溶液.
假设一:只含有NH3.
假设二:既有NH3又有Cl2.
假设三: .
甲同学认为向KI淀粉混合液中通入G口导出气体,溶液变蓝,假设二或假设三成立.
乙同学认为向KI淀粉混合液中通入G口导出气体,溶液不变蓝,假设一成立.
你认为上述两同学结论,谁不合理,理由是 .

请回答下列问题:
(1)如图组装好各装置,各仪器中装入适量药品后,检测装置气密性的方法是
(2)装置F中发生反应的离子方程式为
(3)通入装置C的两根导气管左边较长,右边较短,目的是
(4)某甲、乙两同学为了探究G口逸出气体的成份,进行如下假设和探究.实验选用试剂有0.1mol/LKI溶液,2%淀粉溶液.
假设一:只含有NH3.
假设二:既有NH3又有Cl2.
假设三:
甲同学认为向KI淀粉混合液中通入G口导出气体,溶液变蓝,假设二或假设三成立.
乙同学认为向KI淀粉混合液中通入G口导出气体,溶液不变蓝,假设一成立.
你认为上述两同学结论,谁不合理,理由是
考点:性质实验方案的设计
专题:
分析:(1)将G导管堵住,将F分液漏斗活塞打开,分液漏斗中液体若不能流出,则装置的气密性良好;
(2)F为浓盐酸与二氧化锰加热反应制取氯气装置,写出该反应的离子方程式;
(3)根据氨气的密度小于空气分析;装置C中出现白烟时,证明氨气与氯气反应生成氯化铵,根据化合价变化还会生成氮气;氯化铵为固体,溶液堵塞导管;
(4)根据假设一、假设二推断假设三;根据在溶液中NH3能与Cl2反应进行判断.
(2)F为浓盐酸与二氧化锰加热反应制取氯气装置,写出该反应的离子方程式;
(3)根据氨气的密度小于空气分析;装置C中出现白烟时,证明氨气与氯气反应生成氯化铵,根据化合价变化还会生成氮气;氯化铵为固体,溶液堵塞导管;
(4)根据假设一、假设二推断假设三;根据在溶液中NH3能与Cl2反应进行判断.
解答:
解:(1)如图组装好各装置,各仪器中装入适量药品后,检测装置气密性的方法为:堵住G导管口,将F分液漏斗活塞打开,分液漏斗中的液体不能顺利放出时,说明装置气密性好,
故答案为:堵住G导管口,将F分液漏斗活塞打开,分液漏斗中的液体不能顺利放出时,说明装置气密性好;
(2)制取Cl2的化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,改写成离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(3)氨气密度小于空气,通入装置C的两根导气管左边较长,右边较短,可以使使Cl2与NH3快速充分混合而反应;当C中产生出现白烟现象,证明Cl2和NH3发生反应生成了氯化铵和氮气;C中的导管较小,生成NH4Cl固体易堵塞导气管,
故答案为:使Cl2与NH3快速充分混合;白烟;NH4Cl、N2;生成NH4Cl固体易堵塞导气管;
(4)根据假设一、假设二可知,假设三为:只含有Cl2 ;
向KI淀粉混合液中通入G口导出气体,溶液变蓝,说明气体中一定含有氯气,则假设二或假设三成立,所以甲结论正确;而因在溶液中NH3能与Cl2反应,不能说导出气体中只有NH3,所以乙同学不合理,
故答案为:只含有Cl2 ;乙同学推测不合理,因在溶液中NH3能与Cl2反应,不能说导出气体中只有NH3.
故答案为:堵住G导管口,将F分液漏斗活塞打开,分液漏斗中的液体不能顺利放出时,说明装置气密性好;
(2)制取Cl2的化学方程式为:MnO2+4HCl(浓)
| ||
| ||
故答案为:MnO2+4H++2Cl-
| ||
(3)氨气密度小于空气,通入装置C的两根导气管左边较长,右边较短,可以使使Cl2与NH3快速充分混合而反应;当C中产生出现白烟现象,证明Cl2和NH3发生反应生成了氯化铵和氮气;C中的导管较小,生成NH4Cl固体易堵塞导气管,
故答案为:使Cl2与NH3快速充分混合;白烟;NH4Cl、N2;生成NH4Cl固体易堵塞导气管;
(4)根据假设一、假设二可知,假设三为:只含有Cl2 ;
向KI淀粉混合液中通入G口导出气体,溶液变蓝,说明气体中一定含有氯气,则假设二或假设三成立,所以甲结论正确;而因在溶液中NH3能与Cl2反应,不能说导出气体中只有NH3,所以乙同学不合理,
故答案为:只含有Cl2 ;乙同学推测不合理,因在溶液中NH3能与Cl2反应,不能说导出气体中只有NH3.
点评:本题考查了性质实验方案的设计与评价,题目难度中等,明确实验目的及实验方案设计的原则为解答关键,注意掌握化学实验基本操作方法,试题侧重考查学生的分析、理解能力及化学实验能力.

练习册系列答案
相关题目
将a mol氮气和b mol氢气及c mol氨气混合充入一密闭容器中反应,在一定条件下到达平衡时,测知容器内氨气为x mol 这x的取值为( )
| A、c+2a | ||
B、
| ||
| C、0<x<c | ||
| D、c<x<c+2a |
下列有关实验的叙述中正确的是( )
| A、用烧杯给液态物质加热时,不用垫石棉垫 |
| B、加热蒸干AlCl3溶液得到Al2O3固体 |
| C、在用托盘天平称量固体药品时,药品放在右盘上 |
| D、如果未知溶液中滴加BaCl2溶液有白色沉淀生成,证明一定含有SO42-离子 |
在如图装置中,若通电一段时间后乙装置左侧电极增加,则下列说法中错误的是( )


| A、乙中左侧电极反应式:Cu2++2e-═Cu |
| B、电解过程中装置丙的pH无变化 |
| C、向甲中通入适量的HCI气体,可使溶液恢复到电解前的状态 |
| D、当甲装置中产生标准状况下4.48L气体时,Cu电极上质量增加43.2g |

 ,则符合下列条件F的同分异构体有
,则符合下列条件F的同分异构体有 结构.
结构. 可简写为
可简写为 .现有某化合物X的分子结构可表示为
.现有某化合物X的分子结构可表示为 .
.



 在室温和大气压强下,用如图装置进行实验,测得a g含CaC290%的样品与水完全反应产生的气体体积为 b L.现欲在相同条件下,测定某电石试样中CaC2的质量分数,请回答下列问题:
在室温和大气压强下,用如图装置进行实验,测得a g含CaC290%的样品与水完全反应产生的气体体积为 b L.现欲在相同条件下,测定某电石试样中CaC2的质量分数,请回答下列问题: