题目内容
镭是元素周期表中第七周期的ⅡA族元素.下面关于镭的性质的描述中不正确的是( )
| A、价层电子构型为7S2 |
| B、单质能与冷水反应,放出氢气 |
| C、氢氧化物呈两性 |
| D、碳酸盐难溶于水 |
考点:同一主族内元素性质递变规律与原子结构的关系
专题:元素周期律与元素周期表专题
分析:镭是元素周期表中第七周期的ⅡA族元素,最外层有2个电子,性质活泼,易与水反应,利用同主族元素金属性的递变规律分析.
解答:
解:A、价层电子构型为7S2,故A正确;
B、性质活泼,易与水反应,故B正确;
C、氢氧化物呈碱性,故C错误;
D、碳酸钡难溶于水,故D正确;
故选C.
B、性质活泼,易与水反应,故B正确;
C、氢氧化物呈碱性,故C错误;
D、碳酸钡难溶于水,故D正确;
故选C.
点评:本题考查同主族元素的性质的递变规律,从同主族元素金属性对应单质、化合物的性质的相似性和递变性的角度解答该题,题目难度不大.

练习册系列答案
相关题目
形形色色的硅酸盐存在于地球的每一个角落,在人类的生活和生产中扮演着重要的角色,下列说法不正确的是( )
| A、古代的陶瓷、砖瓦,现代的玻璃、水泥等,都是硅酸盐产品 |
| B、硅晶体的导电性介于导体和绝缘体之间,是一种重要的半导体材料 |
| C、硅酸、二氧化硅、硅酸钠及硅酸盐产品均属于电解质 |
| D、青花瓷胎体的原料为高岭土[Al2Si2O5(OH)4],若以氧化物形式科表示为:Al2O3?2SiO2?2H2O |
苯在一定条件下可与浓HNO3发生如下反应 ,该反应属于( )
,该反应属于( )
 ,该反应属于( )
,该反应属于( )| A、加成反应 | B、酯化反应 |
| C、取代反应 | D、氧化反应 |
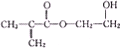 甲基丙烯酸烃乙酯是一种有机合成中重要的原料,其结构简式如图所示,下列有关说法错误的是( )
甲基丙烯酸烃乙酯是一种有机合成中重要的原料,其结构简式如图所示,下列有关说法错误的是( )| A、能发生加成反应 |
| B、能发生取代反应 |
| C、一定条件下,能与乙醇发生酯化反应 |
| D、既能是溴水褪色,又能使酸性高猛酸钾溶液褪色 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、滴加石蕊试液显红色的溶液:Fe3+、SO42-、Cl-、SCN- | ||
| B、滴加甲基橙呈红色的溶液:NH4+、Ba2+、Al3+、Cl- | ||
C、
| ||
| D、c(AI3+)=0.5mol?L-1的溶液:Na+、K+、HCO3-、SO42- |
NA表示阿伏加德罗常数的值,下列说法中不正确的是( )
| A、含0.1mol BaCl2的溶液中Cl-数为0.2NA |
| B、22g CO2所含有的分子数为0.5NA 已知M(CO2)=44g/mol |
| C、11.2L CO2所含有的分子数为0.5NA |
| D、常温下NA个N2分子电子数为14NA |
下列表达方式不正确的是( )
A、二氧化碳的电子式是 | ||
B、氟化钠的电子式  | ||
C、S2-离子的结构示意图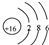 | ||
D、镁-24原子
|
下列化工生产过程所发生的反应不属于氧化还原反应的是( )
| A、用氯气和消石灰制漂白粉 |
| B、用纯碱、石灰石和石英制普通玻璃 |
| C、用石油炼制过程脱硫得到的硫磺制造硫酸 |
| D、用金属钠从四氯化钛(TiCl4)中提炼金属钛 |
 下面的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,B为液体,C能使湿润的红色石蕊试纸变蓝.A、B、C的物质的量之比为1:1:1.
下面的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,B为液体,C能使湿润的红色石蕊试纸变蓝.A、B、C的物质的量之比为1:1:1.