题目内容
4.在无色、碱性溶液中能大量共存的一组离子是( )| A. | Ca2+、Na+、SO42-、MnO4- | B. | K+、Fe2+、SO42-、HCO3- | ||
| C. | Ba2+、K+、Al3+、Cl- | D. | Na+、Ba2+、Cl-、NO3- |
分析 碱性溶液中含大量的氢氧根离子,根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.碱性溶液中不能大量存在Ca2+,Ca2+、SO42-结合生成沉淀,且MnO4-为紫色,与无色不符,故A错误;
B.碱性溶液中不能大量存在Fe2+、HCO3-,且Fe2+为浅绿色,与无色不符,故B错误;
C.碱性溶液中不能大量存在Al3+,故C错误;
D.碱性溶液中该组离子之间不反应,可大量共存,且离子均为无色,故D正确;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存及分析与应用能力的考查,注意常见离子的颜色,题目难度不大.

练习册系列答案
相关题目
14.下列实验装置能达到实验目的是( )
| A. |  海水蒸馏 | B. |  钾在空气中的燃烧 | ||
| C. |  测定中和热 | D. |  牺牲阳极的阴极保护法 |
15.氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题.
(1)氮、磷、砷的电负性的大小关系是N>P>As,砷原子M层电子排布式为3s23p63d10.
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为配位键,该化学键能够形成的原因是
Fe3+提供空轨道,CN-提供孤电子形成配位键.
(3)已知:
分析上表中四种物质的相关数据,请回答:
①CH4和SiH4比较,沸点高低的原因是CH4和SiH4比较,影响熔沸点的因素是分子间作用力,SiH4之间的分子间作用力大,熔沸点高.
②NH3和PH3比较,分解温度高低的原因是NH3和PH3比较,影响分解温度的因素是共价键的强弱,N原子的半径比P原子的半径小,共价键的键长短,供价键强,分解温度高.
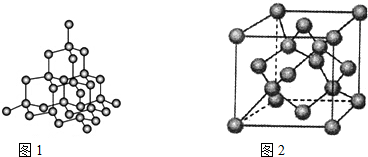
(4)金刚石是原子晶体,含有的最小环是六元环(如图2),每个碳原子连接12个六元环,如图1是金刚石的晶胞,若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,碳原子在晶胞中的空间占有率$\frac{32π{r}^{3}}{3{a}^{3}}$×100%(不要求计算过程).
(1)氮、磷、砷的电负性的大小关系是N>P>As,砷原子M层电子排布式为3s23p63d10.
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为配位键,该化学键能够形成的原因是
Fe3+提供空轨道,CN-提供孤电子形成配位键.
(3)已知:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
①CH4和SiH4比较,沸点高低的原因是CH4和SiH4比较,影响熔沸点的因素是分子间作用力,SiH4之间的分子间作用力大,熔沸点高.
②NH3和PH3比较,分解温度高低的原因是NH3和PH3比较,影响分解温度的因素是共价键的强弱,N原子的半径比P原子的半径小,共价键的键长短,供价键强,分解温度高.

(4)金刚石是原子晶体,含有的最小环是六元环(如图2),每个碳原子连接12个六元环,如图1是金刚石的晶胞,若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,碳原子在晶胞中的空间占有率$\frac{32π{r}^{3}}{3{a}^{3}}$×100%(不要求计算过程).
12.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、NO的混合气体,这些气体与3.2g O2混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,则消耗溶液中NaOH的质量是( )
| A. | 16 g | B. | 32 g | C. | 64 g | D. | 无法计算 |
19. 如图是表示:2X(g)+Y(g)?Z(g)+R(s)+Q(g)的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是( )
如图是表示:2X(g)+Y(g)?Z(g)+R(s)+Q(g)的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是( )
 如图是表示:2X(g)+Y(g)?Z(g)+R(s)+Q(g)的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是( )
如图是表示:2X(g)+Y(g)?Z(g)+R(s)+Q(g)的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是( )| A. | 减少Z物质 | B. | 使用催化剂 | C. | 升高温度 | D. | 加大压强 |
9.下列关于有机物的说法正确的是( )
| A. | 聚乙烯可发生加成反应 | |
| B. | 石油干馏可得到汽油、煤油等 | |
| C. | 丁烷的沸点低于丙醇 | |
| D. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 |
16.室温下,水的电离达到平衡:H2O?H++OH-.下列叙述正确的是( )
| A. | 将水加热,平衡向正反应方向移动,Kw不变 | |
| B. | 向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大 | |
| C. | 向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低 | |
| D. | 向水中加入少量Na2CO3固体,平衡向逆反应方向移动,c(OH-)>c(H+) |
13.需加入适当的氧化剂才能实现的反应是( )
| A. | Fe2O3→Fe3O4 | B. | Na2S4→Na2S2 | C. | S2O32-→S4O62- | D. | Cl3-→Cl- |