题目内容
17.冬日,雪花漫舞,给人带来美的享受,但降雪却会导致道路通行问题.现有一种高速公路的绿色融雪剂-CMA(醋酸钙、醋酸镁固体的混合物),其生产常以白云石(主要成分MgC03•CaC03,含Si02等杂质)和生物质废液--木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)等为原料,流程如图1: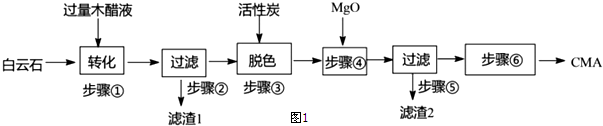
(1)步骤①发生的反应离子方程式为MgCO3•CaCO3+4CH3COOH=Ca2++Mg2++4CH3COO-+2CO2↑+2H2O.
(2)滤渣1的主要成分与NaOH溶液反应的热化学方程式为Si02(s)+2NaOH(aq)=Na2SiO3(aq)+H2O(l),△H=-2QkJ/mol(己知lmol NaOH发生反应时放出热量为QkJ);步骤②所得滤液常呈褐色,分析可知其原因主要是木醋液中含有少量的有色的焦油以及实验过程中苯酚被空气中氧气氧化最终产生褐色物质.
(3)已知CMA中钙、镁的物质的量之比与出水率(与融雪效果成正比)关系如图2所示,步骤④的目的除调节
n(Ca):n(Mg) 约为3:7(选填:1:3; 1:2; 3:7; 2:3)外,另一目的是除去过量的乙酸.

(4)步骤⑥包含的操作有蒸发结晶、过滤、洗涤及干燥.
(5)取akg含MgC03•CaC03质量分数为b%的白云石,经过上述流程制备CMA.已知MgC03'•CaC03的损失率为
c%,步骤④之后到产品CMA的损失率为d%,则结合(3)可知所得产品质量约为($\frac{a×b%(1-c%)×158}{184}+\frac{a×b%×(1-c%)×\frac{7}{3}×142}{184}$)×(1-d%)kg(请用含相关字母的计算式表达,不必化简).
分析 根据流程图可知,白云石(主要成分MgCO3•CaCO3,含SiO2等杂质)与木醋液(主要成分乙酸)反应生成醋酸钙和醋酸镁,过滤得滤渣1为二氧化硅,滤液中主要溶质是醋酸钙和醋酸镁,加入活性碳脱色,再加入氧化镁,调节溶液中n(Ca):n(Mg)的值,过滤,除去混合液中固体杂质,得醋酸钙和醋酸镁溶液,将滤液蒸发结晶、过滤、洗涤及干燥得CMA,
(1)步骤①MgCO3•CaCO3与CH3COOH的反应生成醋酸钙和醋酸镁;
(2)己知lmol NaOH与二氧化硅发生反应时放出热量为QkJ,则反应的热化学方程式为Si02(s)+2NaOH(aq)=Na2SiO3(aq)+H2O(l),△H=-2QkJ/mol,
步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是实验过程中苯酚被空气中氧气氧化最终产生褐色物质;
(3)根据如图2所示钙、镁的物质的量之比与出水率(与融雪效果成正比)关系,可知,当n(Ca):n(Mg)约为3:7时,出水率最高;
(4)根据上面的分析可知,步骤⑥包含的操作有 蒸发结晶、过滤、洗涤及干燥;
(5)取akg含MgC03•CaC03质量分数为b%的白云石,经过上述流程制备CMA.已知MgC03'•CaC03的损失率为c%,则可得n(Ca(CH3COO)2)=$\frac{a×b%(1-c%)}{184}×1{0}^{3}$mol,
n(Mg(CH3COO)2)=$\frac{a×b%(1-c%)}{184}×1{0}^{3}$×$\frac{7}{3}$mol,
步骤④之后到产品CMA的损失率为d%,以此计算产量.
解答 解:根据流程图可知,白云石(主要成分MgCO3•CaCO3,含SiO2等杂质)与木醋液(主要成分乙酸)反应生成醋酸钙和醋酸镁,过滤得滤渣1为二氧化硅,滤液中主要溶质是醋酸钙和醋酸镁,加入活性碳脱色,再加入氧化镁,调节溶液中n(Ca):n(Mg)的值,过滤,除去混合液中固体杂质,得醋酸钙和醋酸镁溶液,将滤液蒸发结晶、过滤、洗涤及干燥得CMA,
(1)步骤①发生的反应离子方程式为 MgCO3•CaCO3+4CH3COOH=Ca2++Mg2++4CH3COO-+2CO2↑+2H2O,
故答案为:MgCO3•CaCO3+4CH3COOH=Ca2++Mg2++4CH3COO-+2CO2↑+2H2O;
(2)己知lmol NaOH与二氧化硅发生反应时放出热量为QkJ,则反应的热化学方程式为Si02(s)+2NaOH(aq)=Na2SiO3(aq)+H2O(l),△H=-2QkJ/mol,
步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是实验过程中苯酚被空气中氧气氧化最终产生褐色物质,
故答案为:Si02(s)+2NaOH(aq)=Na2SiO3(aq)+H2O(l),△H=-2QkJ/mol;实验过程中苯酚被空气中氧气氧化最终产生褐色物质;
(3)根据如图2所示钙、镁的物质的量之比与出水率(与融雪效果成正比)关系,可知,当n(Ca):n(Mg)约为3:7时,出水率最高,所以步骤④的目的除调节n(Ca):n(Mg)约为3:7,步骤④中加入氧化镁的目的是调节钙、镁离子的物质的量之比,除去过量的乙酸,
故答案为:3:7;除去过量的乙酸;
(4)根据上面的分析可知,步骤⑥包含的操作有 蒸发结晶、过滤、洗涤及干燥,
故答案为:蒸发结晶;
(5)取akg含MgC03•CaC03质量分数为b%的白云石,经过上述流程制备CMA.已知MgC03'•CaC03的损失率为c%,则可得n(Ca(CH3COO)2)=$\frac{a×b%(1-c%)}{184}×1{0}^{3}$mol,
n(Mg(CH3COO)2)=$\frac{a×b%(1-c%)}{184}×1{0}^{3}$×$\frac{7}{3}$mol,
步骤④之后到产品CMA的损失率为d%,
则可知所得产品质量约为 ($\frac{a×b%(1-c%)×158}{184}+\frac{a×b%×(1-c%)×\frac{7}{3}×142}{184}$)×(1-d%),
故答案为:($\frac{a×b%(1-c%)×158}{184}+\frac{a×b%×(1-c%)×\frac{7}{3}×142}{184}$)×(1-d%).
点评 本题考查CMA的工艺流程,侧重考查学生阅读题目获取信息能力、对工艺流程的理解、物质分离提纯与条件控制等,综合性较强,题目难度中等,需要学生具备扎实的基础知识与综合运用知识、信息进行解决问题的能力.

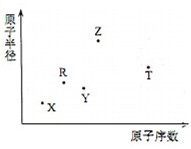 短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R原子最外层电子数是电子层数的2倍.Y与Z能形成Z2Y、Z2Y2型离子化合物.Z与T形成的化合物Z2T能破坏水的电离平衡.下列推断正确的是( )
短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R原子最外层电子数是电子层数的2倍.Y与Z能形成Z2Y、Z2Y2型离子化合物.Z与T形成的化合物Z2T能破坏水的电离平衡.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 氢化物的沸点不一定是:Y>R | |
| C. | 最高价氧化物对应水化物的酸性:T<R | |
| D. | 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性 |
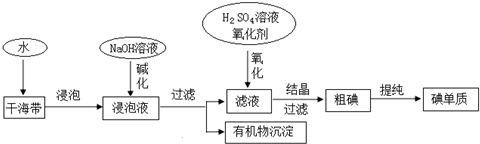
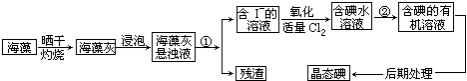
| A. | 因海水中蕴藏着极其丰富的碘元素,所以工业上也可以直接用海水来提取碘元素 | |
| B. | 碱化操作时,加入NaOH溶液的原因是在碱性溶液中,可溶性有机质可形成沉淀 | |
| C. | 在实验室进行氧化操作时,加入的氧化剂可以是新制氯水、双氧水等 | |
| D. | 在实验室进行过滤操作时,需要用到玻璃仪器有玻璃棒、烧杯、漏斗 |
Ⅰ、通过分析,对白色产物成分的可能情况提出了如下几种假设:
假设1:白色产物为Na2O
假设2:白色产物为Na2CO3
假设3:白色产物为Na2O和Na2CO3混合物
Ⅱ、为验证假设3正确,该小组同学设计了如下实验,请你帮他们完成下表内容.
限选试剂:蒸馏水、2mol/L H2SO4、BaCl2溶液、澄清石灰水、酚酞试剂、稀盐酸等;实验仪器任选.
| 实验步骤 | 预期现象及结论 |
①若假设2正确,则金属钠在二氧化碳中燃烧的化学方程式为:4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2CO3+C.
②有同学认为如果CO2足量则不会生成黑色物质,且白色产物成分也可以确定.此时的化学方程式为:2Na+2CO2$\frac{\underline{\;点燃\;}}{\;}$Na2CO3+CO.
| A. | NaOH | B. | Na2O | C. | Na | D. | CaO |
| A. | Si、P、S、Cl元素的单质与氢气化合越来越容易 | |
| B. | 非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强 | |
| C. | 元素原子最外层电子数越多,元素金属性越强 | |
| D. | F-、O2-、Mg2+、Na+离子半径逐渐减小 |
 的系统名称是3,4-二甲基-3-乙基己烷.
的系统名称是3,4-二甲基-3-乙基己烷. .
.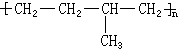 形成该高聚物的单体的结构简式分别为
形成该高聚物的单体的结构简式分别为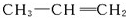 、
、 .
.
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量.回答下列问题: