题目内容
9.(1)100gHCl、NH3、CO2、O2四种气体中,含有分子数目且最小的是CO2,在相同温度和相同压强条件下,体积最大的是NH3;配制100mL0.2mol•L-1CuSO4溶液,需要称量CuSO4•5H2O5.0g.(2)实验室常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O欲制得标准状况下11.2L氯气,则需要43.5gMnO2,被氧化的HCl的物质的量为1mol.
分析 (1)根据N=nNA=$\frac{m}{M}{N}_{A}$知,相同质量时气体分子数与摩尔质量成反比;根据V=nVm=$\frac{m}{M}{V}_{m}$知,相同条件下相同质量时气体体积与摩尔质量成反比;
根据原子守恒知,n(CuSO4•5H2O )=n(CuSO4)=0.2mol/L×0.1L=0.02mol,根据m=nM计算胆矾质量;
(2)标况下n(Cl2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,根据氯气和二氧化锰之间的关系式计算消耗二氧化锰质量,该反应中有一半的HCl被氧化,根据Cl原子守恒计算被氧化HCl物质的量.
解答 解:(1)根据N=nNA=$\frac{m}{M}{N}_{A}$知,相同质量时气体分子数与摩尔质量成反比,这几种气体中摩尔质量最大的是二氧化碳,所以分子个数最少的是CO2;
根据V=nVm=$\frac{m}{M}{V}_{m}$知,相同条件下相同质量时气体体积与摩尔质量成反比,摩尔质量最小的是氨气,所以体积最大的是 NH3;
根据原子守恒知,n(CuSO4•5H2O )=n(CuSO4)=0.2mol/L×0.1L=0.02mol,m(CuSO4•5H2O )=nM=0.02mol×250g/mol=5.0g,
故答案为:CO2; NH3;5.0;
(2)标况下n(Cl2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,消耗二氧化锰质量=$\frac{0.5mol}{1}×1×87g/mol$=43.5g,该反应中有一半的HCl被氧化,根据Cl原子守恒计算被氧化n(HCl)=2n(Cl2)=2×0.5mol=1mol,
故答案为:43.5;1.
点评 本题考查物质的量有关计算,为高频考点,明确各个物理量关系是解本题关键,注意结合原子守恒来分析解答,题目难度不大.

①Si→SiO2$\stackrel{H_{2}O}{→}$H2SiO3
②S$→_{点燃}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4
③Na$\stackrel{H_{2}O}{→}$NaOH$\stackrel{△}{→}$Na2O
④Al→Al2O3→Al(OH)3
⑤N2→NO2→HNO3→NO.
| A. | ①②⑤ | B. | ①②③④ | C. | ②③④ | D. | ①②③④⑤ |
 向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,n(NH3)和n(H2)随时间变化的关系如图所示.下列有关叙述正确的是( )
向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)?2NH3(g)△H<0达到平衡,n(NH3)和n(H2)随时间变化的关系如图所示.下列有关叙述正确的是( )| A. | c点表示NH3生成速率与NH3分解速率相同 | |
| B. | c点和e点时反应的平衡常数相同 | |
| C. | N2的转化率:b>a | |
| D. | d点时,n(N2):n(H2):n(NH3)=1:3:2 |
| A. | 硝酸具有氧化性 | B. | 浓硝酸不能装在铁制容器内 | ||
| C. | 次氯酸是一种强酸 | D. | 钠的焰色为浅紫色 |
| A. | 石油生产汽油的过程中没有发生化学变化 | |
| B. | 氮的固定过程中氮元素被氧化 | |
| C. | 葡糖糖转变成酒精的过程中产生的是水解反应 | |
| D. | 鸡蛋被煮熟的过程中发生的是蛋白质的变性 |
| A. | 硫酸钡 | B. | 蔗糖 | C. | 醋酸 | D. | 二氧化硫 |
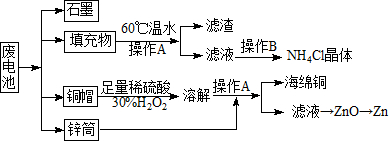 常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害.某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源
常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害.某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源