题目内容
工业上利用某工厂的废渣(主要含CuO 70%、MgFe2O4 20%,还含有少量FeO、NiO等氧化物)制取精铜和颜料铁红.流程如图所示.
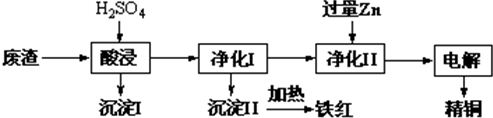
回答下列问题:
(1)净化Ⅰ操作分为两步:
第一步是将溶液中少量的Fe2+氧化;
第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀.
①写出酸性条件下用H2O2氧化Fe2+反应的离子方程式: .
②25℃时,pH=3的溶液中,c(Fe3+)= mol?L-1(已知25℃,Ksp[Fe(OH)3]=4.0×10-38).
③净化Ⅰ中第二步可选用CuO实现转化,用化学平衡移动原理说明其原因: .
(2)用净化Ⅱ所得的金属为电极进行电解得精铜,请写出阴极所发生的电极反应式: .
(3)为准确测定酸浸液中Fe2+的物质的量浓度以确定H2O2的用量,测定步骤如下:
①取出25.00mL酸浸液,配制成250.0mL溶液.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,将0.2000mol/L KMnO4溶液装入 (填仪器名称),进行滴定,记录数据,重复滴定3次,平均消耗KMnO4溶液V mL.(反应离子方程式:5Fe2++MnO4-+10H+═5Fe3++Mn2++5H2O)
③计算酸浸液中Fe2+的物质的量浓度= mol/L(只列出算式,不做运算).

回答下列问题:
(1)净化Ⅰ操作分为两步:
第一步是将溶液中少量的Fe2+氧化;
第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀.
①写出酸性条件下用H2O2氧化Fe2+反应的离子方程式:
②25℃时,pH=3的溶液中,c(Fe3+)=
③净化Ⅰ中第二步可选用CuO实现转化,用化学平衡移动原理说明其原因:
(2)用净化Ⅱ所得的金属为电极进行电解得精铜,请写出阴极所发生的电极反应式:
(3)为准确测定酸浸液中Fe2+的物质的量浓度以确定H2O2的用量,测定步骤如下:
①取出25.00mL酸浸液,配制成250.0mL溶液.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,将0.2000mol/L KMnO4溶液装入
③计算酸浸液中Fe2+的物质的量浓度=
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:(1)①双氧水具有强的氧化性能够氧化二价铁离子;
②根据KSP(Cu(OH)2)计算铁离子浓度;
③依据水解平衡移动的条件,结合工艺流程的目的选择合适的试剂;
(2)电解精炼铜用粗铜作阳极,纯铜作阴极,含铜离子溶液为电镀液进行电解;
(3)高锰酸钾具有强氧化性,应放在酸式滴定管中;依据实验过程和滴定实验消耗的高锰酸钾溶液体积的平均数,结合氧化还原反应离子方程式计算亚铁离子物质的量,计算25ml溶液中亚铁离子的浓度.
②根据KSP(Cu(OH)2)计算铁离子浓度;
③依据水解平衡移动的条件,结合工艺流程的目的选择合适的试剂;
(2)电解精炼铜用粗铜作阳极,纯铜作阴极,含铜离子溶液为电镀液进行电解;
(3)高锰酸钾具有强氧化性,应放在酸式滴定管中;依据实验过程和滴定实验消耗的高锰酸钾溶液体积的平均数,结合氧化还原反应离子方程式计算亚铁离子物质的量,计算25ml溶液中亚铁离子的浓度.
解答:
解:(1)①双氧水与二价铁离子反应的离子方程式为H2O2+2Fe2++2H+═2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+═2Fe3++2H2O;
②溶液的pH=3时,c(H+)=10-3mol/L,c(OH-)=
=10-11mol/,c(Fe3+)=Ksp[Fe(OH)3]÷C3(OH-)=
=4.0×10-5,
故答案为:4.0×10-5;
③三价铁离子水解的离子方程式:Fe3++3H2O?Fe(OH)3+3H+,加入氧化铜,不引入新的杂质,氧化铜与氢离子反应,消耗氢离子,促进水解平衡向正方向移动,生成氢氧化铁沉淀,
故答案为:Fe3+在溶液中存在水解平衡,CuO结合Fe3+水解产生的H+,使溶液中H+浓度降低,促进Fe3+的水解平衡向生成Fe(OH)3方向移动,Fe3+转化为Fe(OH)3沉淀;
(2)电解精炼铜用粗铜作阳极,失电子发生氧化反应,纯铜作阴极,在阴极铜离子得电子发生还原反应,电极反应式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(3)高锰酸钾具有强氧化性,应放在酸式滴定管中;
5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O
5 1
n 0.200mol/L×V×10-3L
n=5×0.200mol/L×V×10-3mol;
c(Fe2+)=
×
;
故答案为:酸式滴定管;
×
.
②溶液的pH=3时,c(H+)=10-3mol/L,c(OH-)=
| 1×10-14 |
| 10-3 |
| 4.0×10-38 |
| (10-11)3 |
故答案为:4.0×10-5;
③三价铁离子水解的离子方程式:Fe3++3H2O?Fe(OH)3+3H+,加入氧化铜,不引入新的杂质,氧化铜与氢离子反应,消耗氢离子,促进水解平衡向正方向移动,生成氢氧化铁沉淀,
故答案为:Fe3+在溶液中存在水解平衡,CuO结合Fe3+水解产生的H+,使溶液中H+浓度降低,促进Fe3+的水解平衡向生成Fe(OH)3方向移动,Fe3+转化为Fe(OH)3沉淀;
(2)电解精炼铜用粗铜作阳极,失电子发生氧化反应,纯铜作阴极,在阴极铜离子得电子发生还原反应,电极反应式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(3)高锰酸钾具有强氧化性,应放在酸式滴定管中;
5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O
5 1
n 0.200mol/L×V×10-3L
n=5×0.200mol/L×V×10-3mol;
c(Fe2+)=
| 250mL |
| 25mL |
| 5×0.200mol/L×V×10-3mol |
| 25×10-3L |
故答案为:酸式滴定管;
| 250mL |
| 25mL |
| 5×0.200mol/L×V×10-3mol |
| 25×10-3L |
点评:本题为工艺流程题,中等难度,通过从废渣中提取氧化铁和金属铜的工艺流程考查了沉淀溶解平衡的计算、水解平衡的移动、氧化还原方程式的书写、物质的分离等,中和滴定的计算等,清楚流程,是解题关键,侧重学生分析问题、解决问题能力的培养.

练习册系列答案
相关题目
25mL浓度为0.04mol?L-1的Na2SO3溶液恰好与20mL浓度为0.02mol?L-1的KRO4溶液完全反应.已知Na2SO3被KRO4氧化为Na2SO4,则R元素在还原产物中的化合价为( )
| A、+2 | B、+3 | C、+4 | D、+5 |
将1mol NaOH溶于水中,配制成1L溶液,则该溶液的物质的量浓度为( )
| A、0.1 mol/L |
| B、0.5 mol/L |
| C、4 mol/L |
| D、1 mol/L |
某氧化物不溶于水,溶于熔化的NaOH中,生成易溶于水的化合物,向稀盐酸中滴加所生成化合物的水溶液,立即有白色沉淀产生,则原氧化物是( )
| A、Al2O3 |
| B、MgO |
| C、SiO2 |
| D、P2O5 |
下列盛放试剂的方法正确的是( )
| A、浓硝酸存放在带橡皮塞的棕色玻璃瓶中 |
| B、汽油或煤油存放在带橡皮塞的棕色玻璃瓶中 |
| C、碳酸钠溶液存放在配有磨口塞的棕色玻璃瓶中 |
| D、氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中 |
在标准状况下,相同质量的下列气体中体积最大的是( )
| A、CO2 |
| B、O2 |
| C、N2 |
| D、CH4 |
溶液、胶体和浊液这三种分散系的本质区别是( )
| A、是否具有丁达尔效应 |
| B、是否能通过滤纸 |
| C、是否透明、均一、稳定 |
| D、分散质粒子直径的大小 |