题目内容
某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜.探究过程如下:
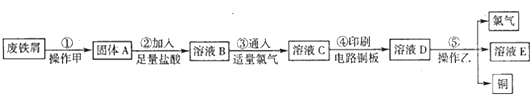
请回答下列问题:
(1)步骤①中先加入热的Na2CO3溶液除油污,操作甲的名称是 .
(2)步骤②中,除发生反应Fe+2HCl FeCl2+H2↑外,其他可能反应的离子方程式为: .
(3)溶液C的颜色是 ,溶液D中可能含有的金属阳离子有 .
(4)可以验证溶液B中是否含有Fe2+的一种试剂是 (填选项序号)
a.稀硫酸 b.铁 c.硫氰化钾 d.酸性高锰酸钾溶液
(5)步骤⑤产生金属铜的化学方程式为 .

请回答下列问题:
(1)步骤①中先加入热的Na2CO3溶液除油污,操作甲的名称是
(2)步骤②中,除发生反应Fe+2HCl FeCl2+H2↑外,其他可能反应的离子方程式为:
(3)溶液C的颜色是
(4)可以验证溶液B中是否含有Fe2+的一种试剂是
a.稀硫酸 b.铁 c.硫氰化钾 d.酸性高锰酸钾溶液
(5)步骤⑤产生金属铜的化学方程式为
考点:物质分离和提纯的方法和基本操作综合应用
专题:
分析:废铁屑经①加入热的Na2CO3溶液除油污,可得到固体A,应经过过滤操作,加入盐酸,发生Fe2O3+6H+═2Fe3++3H2O、Fe+2Fe3+═3Fe2+,然后通入适量的氯气,
发生2Fe2++Cl2=2Fe3++2Cl-,溶液C为FeCl3,用于腐蚀印刷电路,发生Cu+2Fe3+═2Fe2++Cu2+,操作乙可得到氯气、铜和E,应为电解操作,阳极生成氯气,阴极生成铜,最后得到氯化亚铁溶液,以此解答.
发生2Fe2++Cl2=2Fe3++2Cl-,溶液C为FeCl3,用于腐蚀印刷电路,发生Cu+2Fe3+═2Fe2++Cu2+,操作乙可得到氯气、铜和E,应为电解操作,阳极生成氯气,阴极生成铜,最后得到氯化亚铁溶液,以此解答.
解答:
解:(1)废铁屑经①加入热的Na2CO3溶液除油污,可得到固体A,应经过过滤操作,故答案为:过滤;
(2)固体A为Fe2O3和Fe的混合物,加入盐酸,发生Fe2O3+6H+═2Fe3++3H2O、Fe+2Fe3+═3Fe2+,
故答案为:Fe2O3+6H+═2Fe3++3H2O、Fe+2Fe3+═3Fe2+;
(3)通入适量的氯气,发生2Fe2++Cl2=2Fe3++2Cl-,溶液C为FeCl3,呈棕黄色,用于腐蚀印刷电路,发生Cu+2Fe3+═2Fe2++Cu2+,则溶液D中可能含有的金属阳离子有Fe2+、Cu2+、Fe3+,
故答案为:棕黄色;Fe2+、Cu2+、Fe3+;
(4)Fe2+具有还原性,可用酸性高锰酸钾溶液检验,发生氧化还原反应,酸性高锰酸钾溶液褪色,故答案为:d;
(5)步骤⑤产生金属铜的化学方程式为CuCl2
Cu+Cl2↑,
故答案为:CuCl2
Cu+Cl2↑.
(2)固体A为Fe2O3和Fe的混合物,加入盐酸,发生Fe2O3+6H+═2Fe3++3H2O、Fe+2Fe3+═3Fe2+,
故答案为:Fe2O3+6H+═2Fe3++3H2O、Fe+2Fe3+═3Fe2+;
(3)通入适量的氯气,发生2Fe2++Cl2=2Fe3++2Cl-,溶液C为FeCl3,呈棕黄色,用于腐蚀印刷电路,发生Cu+2Fe3+═2Fe2++Cu2+,则溶液D中可能含有的金属阳离子有Fe2+、Cu2+、Fe3+,
故答案为:棕黄色;Fe2+、Cu2+、Fe3+;
(4)Fe2+具有还原性,可用酸性高锰酸钾溶液检验,发生氧化还原反应,酸性高锰酸钾溶液褪色,故答案为:d;
(5)步骤⑤产生金属铜的化学方程式为CuCl2
| ||
故答案为:CuCl2
| ||
点评:本题考查物质的分离、提纯和制备,综合考查学生的分析能力和实验能力,为高考常见题型,注意把握物质的性质以及物质分离的方法,难度中等.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
中和热的测定实验中,可能用到下列仪器:①托盘天平 ②量筒 ③烧杯 ④温度计 ⑤小试管 ⑥酒精灯.其中应使用仪器的正确组合是( )
| A、①②⑤ | B、②③④ |
| C、②③⑥ | D、全部 |
化学工作者从有机反应RH+Cl2(g)═RCl(l)+HCl(g)中受到启发,提出的在农药和有机合成工业中可获得副产品盐酸的设想已成为现实.试指出从上述反应产物中分离得到盐酸的最佳方法是(g表示物质为气态,l表示物质为液态.HCl极易溶于水,得到盐酸;有机物一般难溶于水)( )
| A、蒸馏法 | B、水洗分液法 |
| C、升华法 | D、有机溶剂萃取法 |
关于如图装置说法正确的是( )
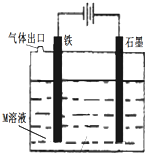

| A、装置中电子移动的途径是:负极→Fe→M溶液→石墨→正极 |
| B、若M为FeCl2溶液,可以实现石墨上镀铁 |
| C、若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀 |
| D、若 M为NaCl溶液,通电段时间后,溶液中可能有NaClO |
H-H、Cl-Cl和H-Cl的键能分别为436、243和431kJ/mol.请用此数据估计由Cl2、H2反应生成1molHCl时的热效应( )
| A、放热183 kJ |
| B、放热91.5 kJ |
| C、吸热183 kJ |
| D、吸热91.5 kJ |
 X、Y、R、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
X、Y、R、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表: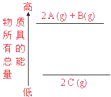 下列说法正确的是( )
下列说法正确的是( )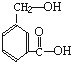 在某有机物A的分子中,具有醇羟基、羧基等官能团,其结构简式如图.
在某有机物A的分子中,具有醇羟基、羧基等官能团,其结构简式如图.