题目内容
某氧化物不溶于水,溶于熔化的NaOH中,生成易溶于水的化合物,向稀盐酸中滴加所生成化合物的水溶液,立即有白色沉淀产生,则原氧化物是( )
| A、Al2O3 |
| B、MgO |
| C、SiO2 |
| D、P2O5 |
考点:硅和二氧化硅,镁、铝的重要化合物
专题:元素及其化合物
分析:A.氧化铝溶于烧碱生成偏铝酸钠,加入过量的盐酸,最终没有沉淀;
B.氧化镁不能溶于烧碱;
C.二氧化硅能和碱反应生成硅酸盐,盐酸酸性强于硅酸,可溶性的硅酸盐滴入盐酸中生成硅酸沉淀;
D.P2O5溶于烧碱生成磷酸钠,加入过量的盐酸,最终没有沉淀;
B.氧化镁不能溶于烧碱;
C.二氧化硅能和碱反应生成硅酸盐,盐酸酸性强于硅酸,可溶性的硅酸盐滴入盐酸中生成硅酸沉淀;
D.P2O5溶于烧碱生成磷酸钠,加入过量的盐酸,最终没有沉淀;
解答:
解:A.氧化铝不溶于水,溶于烧碱溶液生成偏铝酸钠,再加入盐酸,先生成氢氧化铝白色沉淀,继续加入盐酸,氢氧化铝溶解,最终没有沉淀,故A错误;
B.氧化镁不能溶于烧碱溶液,故B错误;
C.二氧化硅不溶于水,溶于烧碱溶液生成硅酸钠,SiO2+2NaOH=Na2SiO3+H2O,再加入盐酸,硅酸钠和盐酸反应生成硅酸和氯化钠,Na2SiO3+2HCl=H2SiO3↓+2NaCl,生成硅酸白色胶状沉淀,故C正确;
D.P2O5溶于烧碱生成磷酸钠,加入过量的盐酸,根据强酸制取弱酸的原理,生成磷酸,无沉淀,故D错误;
故选C.
B.氧化镁不能溶于烧碱溶液,故B错误;
C.二氧化硅不溶于水,溶于烧碱溶液生成硅酸钠,SiO2+2NaOH=Na2SiO3+H2O,再加入盐酸,硅酸钠和盐酸反应生成硅酸和氯化钠,Na2SiO3+2HCl=H2SiO3↓+2NaCl,生成硅酸白色胶状沉淀,故C正确;
D.P2O5溶于烧碱生成磷酸钠,加入过量的盐酸,根据强酸制取弱酸的原理,生成磷酸,无沉淀,故D错误;
故选C.
点评:本题考查元素氧化物性质,难度不大,侧重对基础知识的巩固,需要学生熟练掌握元素化合物性质.

练习册系列答案
相关题目
下列反应中,有沉淀产生且不会消失的是( )
| A、向NaOH溶液中逐滴滴入Fe2(SO4)3溶液直至过量 |
| B、将NaOH溶液逐滴滴入AlCl3溶液中,直至过量 |
| C、向AlCl3溶液中逐滴滴入稀硫酸 |
| D、将氨水逐滴滴入硝酸银溶液中,直至过量 |
0.75molRO32- 共有30mol电子,则R在元素周期表中的位置是( )
| A、.第二周期ⅤA族 |
| B、.第三周期ⅣA族 |
| C、.第二周期ⅥA族 |
| D、.第三周期Ⅶ族 |
在如图所示装置中进行氨的催化氧化实验:往三颈瓶内的浓氨水中不断通人空气,将红热的铂丝插人瓶中并接近液面.反应过程中,可观察到瓶中有红棕色气体产生,铂丝始终保持红热.下列有关说法错误的是( )
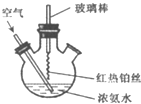

| A、反应后溶液中含有NO3- |
| B、反应后溶液中c(H+)增大 |
| C、实验过程中有化合反应发生 |
| D、实验过程中NH3?H2O的电离常数不可能发生变化 |
我国的“神州五号”载人飞船已发射成功,“嫦娥”探月工程已正式启动.据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以42He的形式存在.下列说法正确的是( )
| A、42He原子核内含有4个质子 |
| B、32He和42He互为同位素 |
| C、32He原子核内含有3个中子 |
| D、42He的最外层电子数为2,所以42He具有较强的金属性 |
中和热的测定实验中,可能用到下列仪器:①托盘天平 ②量筒 ③烧杯 ④温度计 ⑤小试管 ⑥酒精灯.其中应使用仪器的正确组合是( )
| A、①②⑤ | B、②③④ |
| C、②③⑥ | D、全部 |