题目内容
13.电化学在日常生活中用途广泛,图甲是镁-次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理.下列说法正确的是( )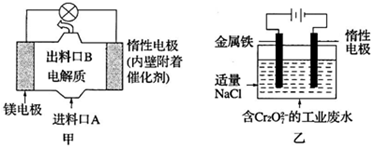
| A. | 图甲中发生的氧化反应是Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| B. | 图乙中惰性电极棒上有O2放出 | |
| C. | 图乙中Cr2O72-向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去 | |
| D. | 若图甲中3.6g镁产生的电量用于图乙废水处理,理论上图乙中有8.4g阳极材料参与反应 |
分析 A.Mg失电子发生氧化反应作负极,负极反应为Mg-2e-=Mg2+,正极反应式为Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓;
B.图乙阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-=H2↑;
C.图乙中Cr2O72-向阳极移动;
D.串联电路中转移电子数相等,若图甲中3.6g镁溶解,电极反应式为Mg-2e-=Mg2+,图乙阳极反应式是Fe-2e-═Fe2+,则图乙中溶解n(Fe)=n(Mg)=$\frac{3.6g}{24g/mol}$=0.15mol.
解答 解:A.Mg失电子发生氧化反应作负极,负极反应为Mg-2e-=Mg2+,正极反应式为Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓,所以图甲中发生的还原反应为Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓,故A错误;
B.图乙阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-=H2↑,所以惰性电极上有氢气生成,故B错误;
C.图乙中Cr2O72-向阳极Fe电极移动,与亚铁离子发生氧化还原反应生成的金属阳离子与惰性电极附近的OH-结合转化成Cr(OH)3除去,故C错误;
D.串联电路中转移电子数相等,若图甲中3.6g镁溶解,电极反应式为Mg-2e-=Mg2+,图乙阳极反应式是Fe-2e-═Fe2+,则图乙中溶解n(Fe)=n(Mg)=$\frac{3.6g}{24g/mol}$=0.15mol,m(Fe)=0.15mol×56g/mol=8.4g,故D正确;
故选D.
点评 本题考查原电池和电解池原理,为高频考点,明确原电池和电解池正负极、阴阳极的判断方法及各个电极上发生的反应是解本题关键,注意:图乙中阳极上Fe失电子而不是溶液中阴离子失电子,阳极生成的亚铁离子要还原Cr2O72-,题目难度不大.

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案| A. | 含1 molHC1和1 molKOH的两种稀溶液混合 | |
| B. | 含1 molHC1和0.5 molKOH 的两种稀溶液混合 | |
| C. | 含0.5mo溶质的浓硫酸和含1mol溶质KOH溶液混合 | |
| D. | 向0.5 mol溶质的浓硫酸和含2mol溶质的KOH溶液混合向1 molNa0H烧碱固体中加入足量1 mol•L-1的硝酸 |
| A. | 生铁 | B. | 硫酸 | C. | 烧碱 | D. | 纯碱 |
| A. | 升高温度,对正反应的反应速率影响更大 | |
| B. | 增大压强,对正反应的反应速率影响更大 | |
| C. | 减小反应物浓度,对逆反应的反应速率影响更大 | |
| D. | 加入催化剂,对逆反应的反应速率影响更大 |
| A. | 溴苯中的溴(KI溶液) | B. | 乙烷中的乙烯(KMnO4酸性溶液) | ||
| C. | 乙酸乙酯中的乙酸(饱和Na2CO3溶液) | D. | 苯中的甲苯(溴水) |
| A. | 7种 | B. | 8 种 | C. | 9 种 | D. | 10种 |
| A. | 只有活泼金属与活泼非金属之间才能形成离子键 | |
| B. | 具有共价键的化合物是共价化合物 | |
| C. | 化学键是分子中多个原子之间强烈的相互作用 | |
| D. | 具有离子键的化合物是离子化合物 |
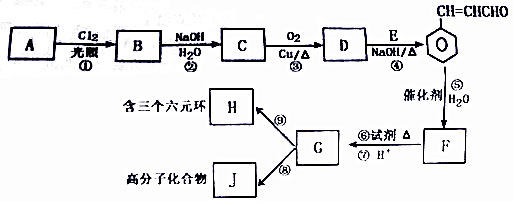
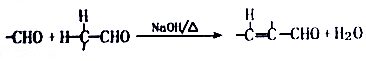
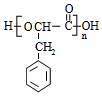 .
.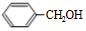 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2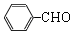 +H2O.
+H2O.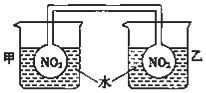 利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.
利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.